单克隆抗体开发和生产服务

加快生物药物开发之旅
通过Millipore® CTDMO 服务,我们为单克隆抗体、双特异性抗体、融合蛋白和抗体片段的研发和生产的各个阶段提供深厚的技术专长和灵活的解决方案。我们帮助客户平衡风险,支持客户完成产品上市过程中的各种监管合规工作,加快上市速度。
我们的服务涵盖哺乳动物细胞株和工艺开发、培养基和补料筛选、主细胞库构建、放大以及GMP级临床和商业化原料药生产。另外,我们还可自主完成分析方法开发、验证和检测。
我们的业绩记录
35+
年的工艺开发经验
25+
年的GMP生产经验
10+
年的灵活一次性生产经验
85+
GMP批次已在过去10年获批放行

开发
细胞系开发
对表达目的基因的细胞系进行设计是临床前开发的重要步骤。我们帮助确保客户的细胞系从临床前到商业规模应用都能可靠地生产高质量蛋白质。我们专有的CHOZN® 细胞系开发平台可以更快、更简单地筛选和扩大高产克隆。
我们全面的细胞系开发能力和专业知识可为DNA和载体构建、最优克隆选择、主细胞库研究以及稳定性研究提供支持。
初期工艺开发
当我们的客户从细胞系转向上下游工艺开发时,我们可帮助构建稳健的可扩展工艺,为客户的现在和将来带来成功。我们一直以来都致力于加快报批流程,帮助客户满足IND/IMPD申报的有关质量、安全性和监管要求。
单克隆抗体快速开发计划 — 从转染到GMP原料药仅需9个月
我们的单克隆抗体快速开发计划利用与开发阶段相适应且高性价比的成熟工艺,可将IgG1和IgG4单克隆抗体的开发周期缩短到9个月。该计划集中体现了我们35年多的单克隆抗体开发和工艺知识、持续创新、高质量标准、风险规避以及在CMC和监管要求方面的深厚专业知识。
后期工艺优化、扩展和验证
当我们的客户转向商业化生物制药生产时,我们提供后期能力,帮助完成生产准备。我们的多学科团队具有25年多的GMP生产经验。我们提供技术、设备和专家咨询,使我们的客户能够调整、扩展和验证他们的生产工艺,以满足市场需求。


质量/监管服务
从开发的最初阶段开始,我们在进行分析开发的同时收集、验证和记录数据,以保证产品质量和工艺稳健性。
质量和CMC监管支持
- 稳健的质量管理体系
- 符合GMP的质量保证
- 药物开发和生产的CMC监管支持
- 从最初申报到获批后生命周期管理的CMC监管支持
- 通用技术文件的格式化信息
分析方法开发
- 细胞库表征
- 分析方法开发、实施和验证
- 过程中控制测试
- 质谱测定能力
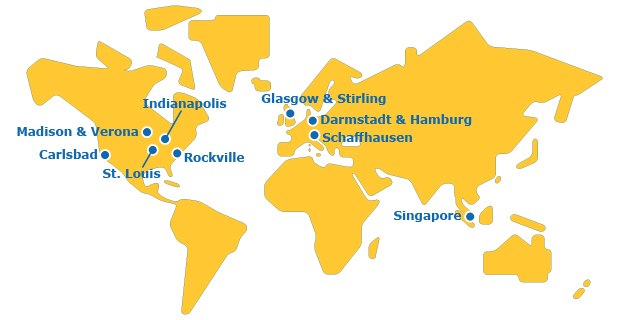
全球足迹
我们是一个拥有全球网络的组织,提供覆盖分子价值链各阶段的CDMO服务。
高度互联的CDMO网络确保开发和生产单克隆抗体、双特异性抗体、融合蛋白和抗体片段的速度、质量、可扩展性和灵活性。

我们的上海基地是我们“中国生物药物检测中心”的大本营,配备病毒清除研究全套设施。这使我们的客户能够立足本土从临床前开发到国内乃至全球范围内的商业化开展病毒清除研究。

我们法国马尔蒂拉克(Martillac)基地始建于1987年,如今已成长为一个全集成的基地,提供工艺开发、多达200L的试生产和多达2000L的GMP临床和商业化生产。

从早期临床前开发到获批生产,我们的检测和生产服务覆盖整个产品生命周期。服务包括分析方法开发、细胞库建库、细胞系特征鉴定、病毒清除、原料药和成品药放行测试以及快速方法。
相关产品资源
- Why Choosing a Client-centric CTDMO is Critical when Outsourcing
This infographic discoveres 5 considerations, that are most critical as indicators of success.
- Trends in Outsourcing the Development and Manufacturing of Biologics
In this whitepaper, we share highlights from a global market research survey of small, midsized and large biopharmaceutical companies on trends related to outsourcing.
- A Molecule’s Journey Break Down Roadblocks to Clinical Success
A guidebook for today’s biopharma executives seeking to navigate through the important considerations necessary to successfully bring a molecule to the clinic.
- Optimize the Formulation for a Monoclonal Antibody
This case study shows, how our innovative, custom solutions and decades of expertise allow to effectively balance cost, speed and risk when optimizing drug substance formulations in an accelerated timeframe.
- Reduce the Level of Host Cell Proteins in the Bioreactor Harvest
Learn how conceptualized and effective approaches help to address process development challenges such as HCP removal, in an accelerated timeframe.
- Scale your Process Directly from 3L to 2000L
In this case study we showcase how to advance a drug candidate into the clinic and ultimately onto the market faster.
- A Molecule’s Journey: Break Down Roadblocks to Commercial Manufacturing Success
A guidebook for today’s biopharma executives outlining key considerations to help ensure commercial manufacturing success.
如要继续阅读,请登录或创建帐户。
暂无帐户?