使用抗体 Atto 染料缀合物进行荧光多重检测
免疫印迹(蛋白质印迹转印)是现代蛋白质组学研究中的常用技术。电泳后,蛋白质固定在硝酸纤维素膜或 PVDF 膜上,即可用靶向目标蛋白质的一抗进行检测。随后,与辣根过氧化物酶或碱性磷酸酶缀合的二抗与一抗缀合。加入化学发光酶底物,通过 CCD 相机或 X 射线胶片曝光检测发出的光线。通常,免疫印迹检测靶向某一蛋白质。但在某些应用中——如磷酸化和非磷酸化状态的蛋白质对比,或目标蛋白质相对于对照蛋白质(例如肌动蛋白)的相对丰度测定——需要在一张膜上进行多重检测。
我们提供与明亮荧光 Atto 染料共价缀合的二抗。可使用两种与不同激发/发射波长的 Atto 染料缀合的二抗进行免疫印迹多重分析(图 1)。印迹膜无需剥离和重新转印即可进行后续检测,减少了处理步骤并最大限度减少了错误来源。
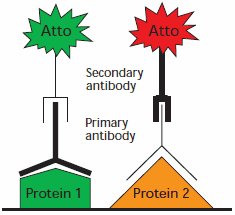
图 1.使用两种二抗和不同 Atto 染料进行多重检测的示意图。
双色多重免疫印迹
在我们的第一个实验中,在 4-20% SDS-PAGE(Tris-甘氨酸)凝胶上分离蛋白质 1 和蛋白质 2(各 500 ng)。将蛋白质转印到弱荧光 PVDF 膜上,并使用溶于 PBS 的 5% BSA 进行封闭。将膜与蛋白质 1 和蛋白质 2 的抗体(各 1:1000)一同孵育。
使用小鼠一抗检测蛋白质 1,然后使用山羊抗小鼠-IgG-Atto 550(货号43394,1:1250稀释) (λex = 532 nm, λem = 580 nm)检测。使用兔一抗检测蛋白质 2,然后使用山羊抗兔-IgG-Atto 633(货号41176,1:1250稀释) (λex = 633 nm, λem = 675 nm)检测。各自单独泳道或同一泳道组合检测时,在同一张膜上均检测到两种蛋白质(图2)。
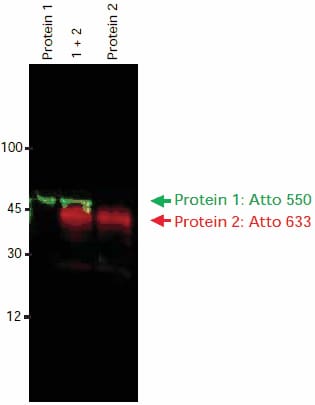
图 2.使用两种一抗和两种抗IgG抗体-Atto缀合物对蛋白1和蛋白2进行免疫印迹检测。两种二抗均源自同一物种(山羊)。依次使用 FLA-3000 Fuji® 激光扫描仪进行成像,首先使用 580 nm 发射滤光片以 532 nm 的激发波长进行成像,然后使用 675 nm 发射滤光片以 633 nm 的激发波长进行成像。使用软件工具叠加图像。
使用 Atto 染料缀合抗体进行常规免疫印迹检测
Atto 染料缀合抗体还可用于常规免疫印迹。氨基末端 FLAG-BAP™ 融合蛋白(货号P7582)的检测限(采用山羊抗小鼠-IgG-Atto 647N(货号50185)和山羊抗小鼠-IgG-Atto 550(货号43394)缀合物进行)通过单独的实验揭示(图3)。在 4-20% SDS-PAGE 凝胶上分离 FLAG-BAP 蛋白 (5-500 ng)。将蛋白质转印到弱荧光 PVDF 膜上,并使用溶于 PBS 的 5% BSA 进行封闭过夜。将膜和ANTI-FLAG® M2单克隆抗体(货号F1804,1:1000稀释)一起孵育。使用山羊抗小鼠-IgG-Atto 647N (1:1250) (λex = 633 nm, λem = 675 nm)检测一块膜。FLAG-BAP 蛋白的最低检出量为 5 ng。使用山羊抗小鼠-IgG-Atto 550 (1:1250) (λex = 532 nm, λem = 580 nm)检测第二块膜。FLAG-BAP 蛋白的最低检出量为 20 ng。检测时,Atto 550采用532 nm激光和580 nm发射滤光片的组合,Atto 647N采用633 nm激光和675 nm发射滤光片的组合。 其他成像系统也可采用对应的激发光源和发射滤光片设置。

图 3.采用Atto染料标记抗体免疫印迹检测FLAG-BAP蛋白(500 ng – 5 ng)。
图A:所用抗体为和山羊抗小鼠-IgG-Atto 647N。激发波长633 nm、发射波长560 nm下进行成像。
图B:所用抗体为和山羊抗小鼠-IgG-Atto 550。激发波长532 nm、发射波长580 nm下进行成像。在 FLA-3000 Fuji 激光扫描仪上成像。其他实验详情,请参阅对应文本。
附加建议
- 可无需混合,连续与一抗的孵育,以确保抗体可重复使用。
- 为避免交叉反应,一抗必须来自不同宿主,二抗必须来自同一宿主。
- 必须使用弱荧光PVDF膜(例如ImmobilonTM-FL),避免高背景。
- 干燥膜可增强信号强度。
Atto 标记抗体为无需酶底物的免疫印迹检测以及单膜多重检测提供了全新可能性。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?