碱性磷酸酶
碱性磷酸酶—检测体系、分子量、底物和结构
我们提供了广泛的碱性磷酸酶(ALP/ALKP)制剂,可针对ELISA、免疫印迹和组织化学检测应用需求优化与抗体和其他蛋白质的结合。我们的BioUltra级碱性磷酸酶具有非常高的比活性,特别适合需要高灵敏度的蛋白质标记。
蛋白质免疫印迹

图 1.用抗FLAG抗体和ALP标记的二抗检测FLAG-BAP对照蛋白,并用BCIP / NBT底物(使用ProteoQuest 免疫印迹试剂盒(比色法),B6404)进行染色。
免疫组化
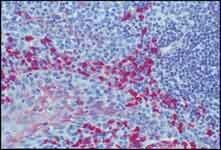
图 2.用单克隆抗人IgA(克隆GA-112,货号I0636)以及SIGMAFAST™ Fast Red TR/Naphthol AS-MX片剂(货号F4523)底物,用单克隆抗人 IgA 和抗小鼠 IgG ALP 偶联物对福尔马林固定、石蜡包埋的人扁桃体切片进行染色。40x
我们的产品还可用于脱磷酸化酪蛋白和其他蛋白质。ALKP可用于DNA或RNA 5’端的脱磷酸化以防止自连。DNA或RNA在通过ALKP脱磷酸化后也可标记放射性的磷酸盐(通过T4多核苷酸激酶)。
KM:1.5 × 10–3 M (p-硝基苯磷酸酯),19 × 10–3 M (磷酸烯醇式丙酮酸)
分子量:2,3 140–160 kDa (二聚体MW)
E2781%:7.6–10.5
等电点:4,8,9 同工酶在4.4–5.8之间
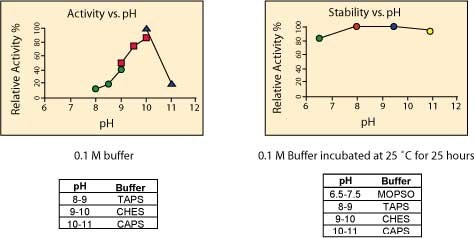
最适pH:该酶最稳定的pH值范围为7.5–9.5.3最佳酶活的pH值是8-10。最适pH值也取决于底物、底物浓度和离子浓度的变化。8本产品的酶活是在pH值为9.8时进行测定的(二乙醇胺缓冲液酶检测法)。
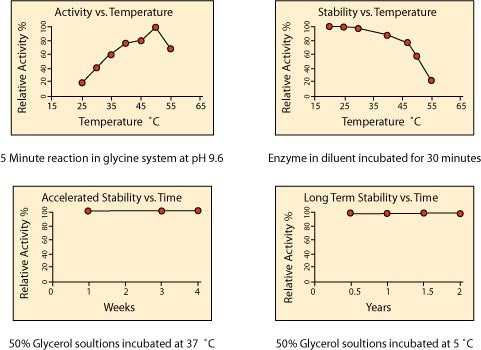
温度对于活性和稳定性的影响
牛碱性磷酸酶的抑制剂
螯合剂、砷酸盐、半胱氨酸、碘、无机磷酸盐、焦磷酸盐、异丙磷、磷酸三苯酯、氟磷酸二和L-苯丙氨酸。9,10
左旋咪唑(货号L9756)通常用来抑制内源性ALKP活性,而对于肠酶只有轻量的抑制作用。11,12
检测实验方案
单位定义:在pH 9.8、37 °C条件下,一单位DEA每分钟可水解1 µmole 的4-硝基苯基磷酸酯。3单位DEA近似于1单位甘氨酸。
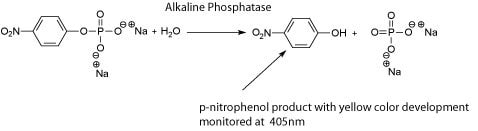
ALP还可用于确定巴氏杀菌对牛奶和奶酪等乳制品的有效性。ALP在约 72°C至少15秒时发生变性。非极端温度条件已被证明能破坏牛奶中的大多数病原体。因此,ALP活性可以用来测量巴氏杀菌的有效性。在过去,有两种方法被用于检测巴氏杀菌后的ALP活性,第一种是通过释放并检测苯酚的Scharer检测法;而第二种方法被称为Aschaffenberg & Mullen检测,通过检测对硝基酚的释放。两种检测都呈现阴性结果则表明ALP完全失活以及大多数乳生病原体的破坏。最近,基于同样ALP活性原理也开发出了新的更灵敏的技术。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?