GenElute™-E纯化方法对DNA定量和下游酶促反应准确性的影响
这种结合-洗涤-洗脱的方法十分繁琐,牵涉反复多次的洗涤和离心步骤。重复的离心步骤造成大量的DNA剪切。另外,还有离液盐等污染物容易污染洗脱的DNA或RNA,对最终纯度、核酸定量以及PCR等下游酶促过程造成不利影响。
我们评估了一种无需高盐结合和乙醇洗涤步骤的单次离心核酸纯化系统。GenElute™-E DNA和RNA纯化试剂盒采用基于分子排阻的负选色谱技术,使细胞、组织、血液等样品中分子量较小的蛋白质、脂质和离子组分与大分子的DNA和RNA相分离(图1-2)。

图 1.体积排阻-负选色谱法纯化核酸。

图 2.对小鼠血液样本,使用GenElute™-E血液DNA单次离心纯化高产试剂盒,洗脱纯化DNA,截留蛋白质、脂质等其他分子。A)纯化基因组DNA的吸光谱(红线)。B)GenElute™-E离心柱截留物的吸光谱(黑线),与纯化DNA的光谱(红线)叠加。截留物光谱显示,蛋白质等其他污染物的OD值在280nm或≤240nm处。注意y轴的比例变化。
我们评价了核酸纯化方法残留杂质对DNA定量和下游酶促的影响。在该比较研究中,分别采用GenElute™-E单次离心纯化法和传统的硅基质结合-洗涤-洗脱离心柱法(硅基质法)制备基因组DNA。使用3种方法检测核酸纯度:
- 紫外分光光度法(OD比值:A260nm/280nm和A260nm/230nm)
- 凝胶电泳
- 定量PCR(qPCR)
结果表明,相比目前的硅基质法,GenElute™-E单次离心DNA/RNA纯化体系纯度更高,后续定量更加准确,对下游酶促反应(如PCR)造成的干扰更少。
对核酸制备中引入杂质的评估
紫外分光光度法评估定量干扰
常见的生物污染物,例如蛋白质、核酸片段、ssDNA、RNA(测DNA时)、引物、以及提取和纯化实验中的离液盐,均会导致核酸浓度高估。其中某些杂质可通过紫外分光光度法检测。本法用紫外光照射纯化DNA/RNA样品,检测不同波长下的样品吸光度。
260 nm吸光度(A260)用于检测核酸。280 nm吸光度(A280)用于检测样品中的蛋白杂质。A260/A280 比值可从蛋白杂质方面衡量样品纯度。高纯DNA的A260/A280≥ 1.8。低于该值说明制成品中含有蛋白杂质。
230 nm吸光度(A230)可用于检测样品中是否存在化学杂质(如离液盐)。理想的A260/A230比值应大于2.0,对PCR等酶法造成的化学干扰才会最低。对于纯度要求高的样品,该值的检测十分重要。
我们检测了GenElute™-E DNA/RNA单次离心纯化系统提取血液样本后的吸光度、A260/280和A260/230比值。与硅基质法竞品提取相同样品后的结果进行比较(图3和表1)。数据表明,GenElute™-E纯化系统获得的制成品中,基因组DNA相比硅基质法纯度更高、生物和化学杂质更少。

图 3.A)某品牌的硅基法DNA试剂盒,或B) GenElute™-E单次离心负选色谱法DNA纯化试剂盒,制得血液基因组DNA的紫外吸收光谱。小图检测的是10X浓度的洗脱组分。仅在硅基质洗脱组分中检测到杂质。黑线:使用所示方法纯化的样品光谱,有过程污染物影响。红线:不含过程污染物的纯化样品光谱,作为基线对照。橙线:没有使用实际样品的纯化光谱,显示过程污染物影响分光计读数。
凝胶电泳法评估剪切DNA和低分子量核酸杂质
通过凝胶电泳技术按大小分离核酸,可直观显示且定量测定样品纯度。电泳中,分子量较大的DNA比小分子的DNA和RNA片段迁移得更慢。用荧光染料染色后,可观察或定量各自条带。
分别采用硅基质法(某品牌试剂盒)或体积排阻-负选色谱法(GenElute™-E单次离心DNA纯化试剂盒)纯化小鼠肝组织样本的DNA,并在琼脂糖凝胶上电泳分离。SYBR green为核酸染料。为了统一结果,每种纯化样品取等量的DNA上样到凝胶泳道上。在荧光透射仪上可视化琼脂糖凝胶,结果显示,相比硅基质法纯化,体积排阻-负选色谱法获得的基因组DNA条带更强(图4)。
硅基质法洗脱的样品在凝胶底部出现微弱条带,代表成品有小分子RNA或剪切DNA的污染。由于凝胶上样统一为样品中的DNA(用260nm处吸光度表示含量),这些数据表明硅基质法中的基因组DNA产量是被高估的,因为其中的小分子核酸杂质同样也有吸光度。GenElute™-E体积排阻-负选色谱法获得的DNA单条带强度更高,说明从组织样本中提取的基因组DNA纯度更高。荧光法定量结果(图5)。
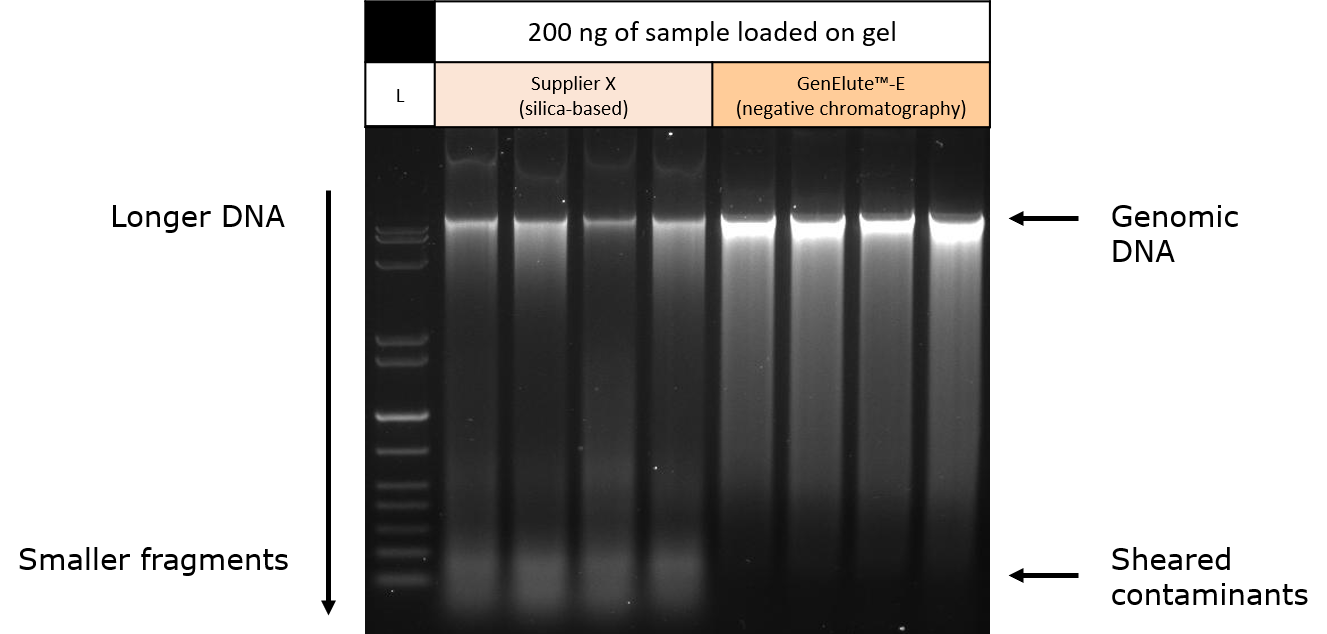
图 4.对鼠肝组织样本提取的基因组DNA进行凝胶电泳。分别采用硅基质法(某品牌)或体积排阻-负选色谱法(GenElute™-E单次离心DNA纯化试剂盒)纯化小鼠组织。适当调配样品,在琼脂糖凝胶每条泳道上样等量DNA。结果表明,硅基质法纯化的样品中存在RNA或剪切DNA杂质。
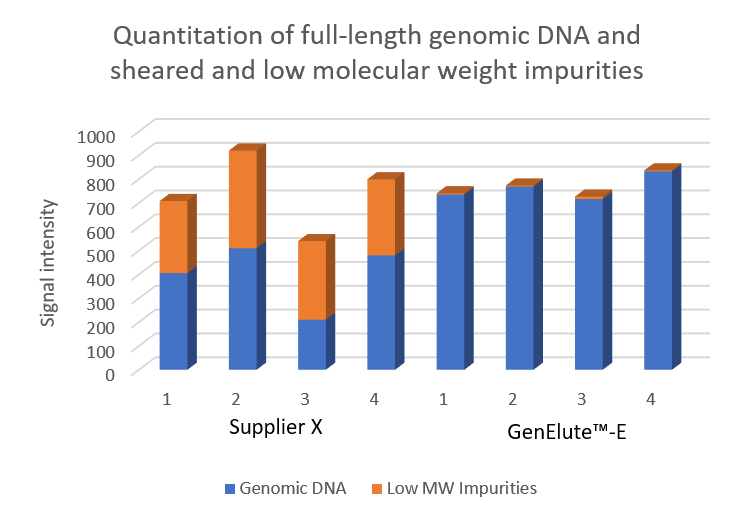
图 5.计算从小鼠肝组织样本获得的基因组DNA(gDNA)产量和RNA/剪切DNA杂质的含量。分别采用硅基质法(某品牌)或体积排阻-负选色谱法(GenElute™-E单次离心DNA纯化试剂盒)纯化样本。通过定量分析SYBR green染色后的荧光信号,计算DNA含量。结果表明,硅基质法纯化的样品中存在大量小分子RNA或剪切DNA污染物。
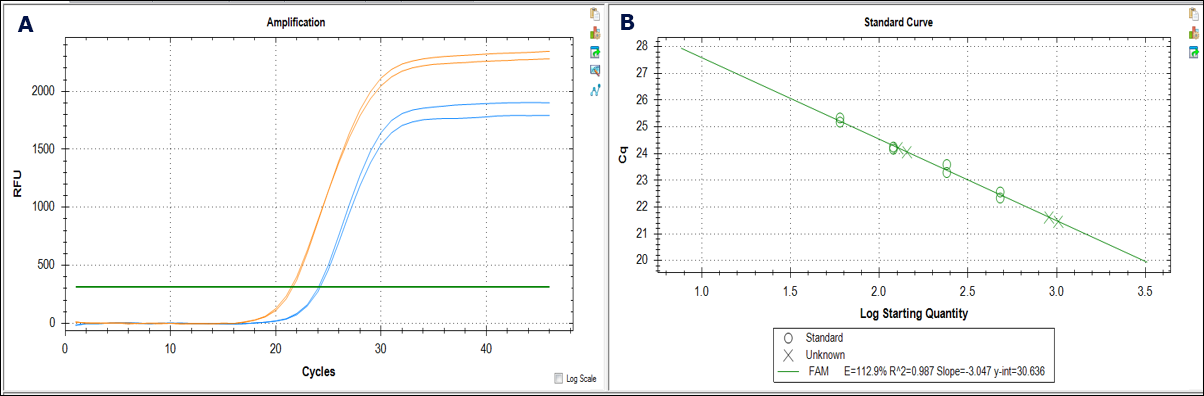
图 6.qPCR实验测定基因组DNA制品中的干扰物。A)分别使用某品牌的硅基质法试剂盒(蓝色曲线)和GenElute™-E体积排阻-负选色谱法试剂盒(橙色曲线)制备小鼠肾组织基因组DNA,生成扩增曲线。相比GenElute™-E纯化样品,硅基质法纯化样品的曲线向右偏移,表明硅基质制品中存在干扰物或起始浓度被高估。B) 用β-肌动蛋白基因作为内标,计算Cq值。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?