用于癌症诊断治疗的磁性纳米颗粒
简介
最近出现的许多高功能纳米材料为癌症的认识、诊断和治疗提供了新的方案。其中,各种各样的功能磁性纳米颗粒——包括铁、钴、锰和镍的超顺磁铁氧体纳米颗粒在内——已被证明对生物医学的应用极其有益。1–6为了其在未来治疗的前景,多功能铁磁流体(MF)目前正在被格外深入研究。5,6
铁磁流体是磁性纳米颗粒的悬浮液,其在永久磁场下表现为“液态磁体”。铁磁流体可以被很容易地修饰,可包含不同的生物和非生物来源的表面官能团7,8,用于结合治疗有效负载和成像分子,从而增强靶向治疗和诊断的特异性。此外,MF在交变磁场之下表现出独特的产热能力。9由于癌细胞对升高的温度(高于42°C)表现出较低的耐受性,因此预计MFs的局部热量可用于癌细胞的靶向治疗(热疗治疗)。10–12磁热疗也可用于从MFs中释放治疗有效负载,从而提高在直接肿瘤环境中的释放效率。
MF具有许多独特的特征,可能具有潜在的显著治疗优势,包括:
- 具有最小颗粒凝聚的水胶体稳定性
- 增强的装载效率,可同时作为亲水和疏水药物的平台
- 在单个系统中封装多种药物
- 在外部刺激如pH、温度、交流磁场和超声波的影响下,于靶位点触发并控制药物的释放
- 可评估的生物相容性和生物降解性
- 可通过机体的网状内皮系统(RES)快速清除
- 降低游离药物的循环浓度,从而减少副作用
- 最小化肿瘤靶位点的多重耐药性
- 同时用于MR成像和其他诊断应用
最近,我们开发了各种基于氧化铁的MF混合体系,它们具有不同的表面官能团,包括树枝状大分子13、脂质14、水凝胶15、生物可降解聚合物、柠檬酸16和二氧化硅等。17表面官能团赋予了这些基于氧化铁的铁磁流体多功能性,并使它们对热和/或pH敏感。13,14基于铁氧化物的MFs在水相条件下高度稳定,并且已经成功地测试了亲水性和疏水性药物的递送,以及在癌细胞系和小鼠的皮下肿瘤模型中的磁热疗应用。本文概述了以下系统针对各种癌细胞系的治疗效果:
- 刺激应答型磁性纳米水凝胶(MNHG)
- Tc调谐的磁性纳米囊泡
- 树突状聚合物功能化的磁性纳米颗粒
- 热和pH应答型薄脂质层包被介孔磁性纳米组装体(LMMNA)
利用磁热疗(与化学疗法协同作用)、非侵入性MR成像和电化学生物传感,这些制剂在双模式癌症治疗中的性能也得到了评估。这些混合系统中的一部分已经开始就体内应用做进一步探索。
刺激应答型磁性纳米水凝胶
水凝胶是以胶体凝胶状态存在的亲水性交联聚合物。由于物理、化学和生物性能可调,它们已经在许多生物医学应用中进行了测试。已经证明,将铁磁流体封装在水凝胶中可以改善其生物医学性能。18例如,Lin等人报道了使用基于聚乙二醇(PEG)的可降解水凝胶来递送化学修饰反义RNA寡核苷酸,这也是一种有希望的癌症治疗方法。19Z hang和其合作者成功地使用基于壳聚糖和β-甘油磷酸盐的磁性水凝胶来持续递送BCG疫苗,用于雌性Wistar大鼠膀胱癌治疗。20Baeza及其合作者利用聚乙烯亚胺-b-聚(N-异丙基丙烯酰胺)与介孔氧化硅以及氧化铁纳米颗粒结合后的热应答共聚物作为磁场诱发型药物释放平台,与肿瘤细胞的多药耐药性作斗争。21
我们小组开发了一种聚(N-异丙基丙烯酰胺)-壳聚糖封端的基于Fe3O4磁性纳米结构(MNS)的磁性纳米水凝胶(MNHG),该技术成功地将癌症化学疗法与非侵入性磁共振成像(MRI)结合了起来。22图1展示了可测量的MRI T2对比(横向自旋松弛)增强和吸收治疗药物相关的递送效果。注意,与POSS官能化Fe3O4封端的水凝胶-MNS系统相比,用PEG官能化的Fe3O4封端的水凝胶-MNS(HGMNS)系统表现出更高的弛豫率(r2),结果分别为173 mM−1s−1和129 mM−1s−1 。将PEG官能化的HGMNS缀合至阿霉素(DOX)的研究显示,在RF(射频)场暴露1小时随后 37℃孵育24小时,药物释放增强接近2倍。在这种情况下,治疗性药物释放的增加归因于周边环境中的微环境加热以及由水凝胶内部的高频RF引起的磁力学振动。此外,用宫颈癌细胞系(HeLa)对PEG官能化的HGMNS的RF诱导药物递送研究显示超过80%的细胞死亡。这些结果表明,因磁性水凝胶系统具有超高的MR对比增强、MNS封端和RF诱导的局部治疗递送,因此其有着潜在的体内诊断治疗功能。
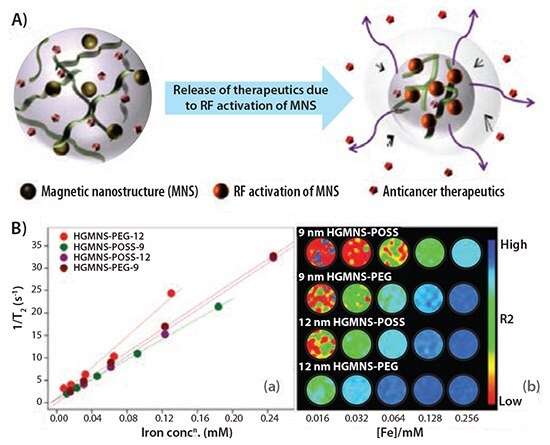
图 1.A)示意图展现了磁性纳米水凝胶的热应答塌陷,由RF暴露导致的治疗药物的释放引起;B) 磁性纳米水凝胶的MR对比度特性。r2是1/T2比上相应样品的铁浓度绘制的直线拟合线的斜率;在相同样品的五个连续稀释的铁浓度下的T2加权的幻影图像。
我们还探索了在皮下纤维肉瘤肿瘤模型中用于局部递送化学治疗剂的热应答聚(N-异丙基丙烯酰胺)-壳聚糖基磁性纳米水凝胶(MNHG)的体内评估。23为此,在瑞士小鼠中评估MNHG的生物相容性和生物分布,同时在交变磁场(AMF)的影响下研究肿瘤生长抑制的功效。还研究了重要器官如肺、肝、脾、肾和脑中的累积MNHG的离体时间依赖性模式。在瘤内给药(剂量I)之后,荷瘤小鼠暴露于在265kHz下操作的325Oe的RF磁场经受热疗。在2周的时间内每隔72小时测量肿瘤大小。该研究显示,与对照小鼠未抑制的指数生长的肿瘤(大小:4,510± 735 mm3)相比,组合疗法使肿瘤的生长减慢了约3倍(大小;1,545 ±720 mm3)。这些结果清楚地表明,MNHG具有显着的作为联合热化疗平台的潜力。
Tc调谐的磁性纳米囊泡
含有紫杉醇(货号T7402)以及葡聚糖包被的La0.75Sr0.25MnO3和Fe3O4磁性纳米颗粒双相悬浮液的磁性纳米囊泡被研发用于化疗和自控(Tc调谐)热疗。24
在37℃下连续释放紫杉醇1小时,然后在44℃下高温加热1小时(正如肿瘤内注射所预期的),导致了对癌细胞的累积毒性。图2显示,在暴露于AMF下,温度控制在44℃,在MCF-7细胞中观察到了紫杉醇和热疗的协同细胞毒性。这表明包含La0.75Sr0.25MnO3和Fe3O4磁性纳米颗粒双相悬浮液且封装紫杉醇的磁性纳米囊泡具有联合自控热疗和化疗的潜力。
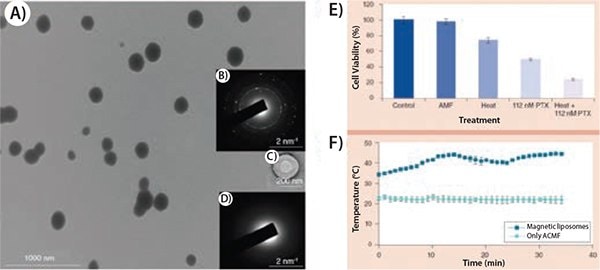
图 2.A) 磁性脂质体的透射电子显微照片,其含有10:1比例的La0.75Sr0.25MnO3和Fe3O4纳米颗粒的双相悬浮液的。图(B,C,D)显示磁性脂质体的衍射图案,空白脂质体的透射电子显微镜图像和空白脂质体的衍射图案。E)MCF-7细胞系在热疗实验中的细胞毒性。F)热疗实验的温度曲线,也仅用于交流磁场。24
树突状聚合物功能化的磁性纳米颗粒
树突状聚合物是一类超分枝的对称聚合物,起源于具有重复分支单元的中央核心。由于它们的结构性质和可控大小,树突状聚合物已经成为生物医学应用中有吸引力的材料,特别是作为治疗性负载的载体。最近,人们尝试将树突状聚合物的独特化学特征与磁性纳米颗粒的多功能性相结合,为增强治疗和生物医学应用提供平台。25例如,Rouhollah及其合作者将磁性纳米颗粒与不同代的聚酰胺胺(PAMAM )树突状聚合物(货号 664138和664049)结合起来,研发了pH应答平台,并将阿霉素递送至耐药乳腺癌细胞(MCF-7) 。26Yalcin及其合作者使用PAMAM包被的磁性纳米颗粒将抗癌药物吉西他滨和视黄酸递送到胰腺癌和星状细胞中,成功地消除了癌细胞27。Boni及其同事使用两亲性PAMAM与疏水性氧化铁纳米颗粒结合来研究MRI应用的弛豫效能28。我们最近研发了树突状聚合物缀合的氧化铁纳米颗粒,探索了PAMAM-Fe3O4-DOX三元组的潜在治疗效率13。使用不同代(G3,G5和G6)的PEG-PAMAMs来修饰谷氨酸缀合的Fe3O4纳米颗粒的表面(图3)。目前正在研究C57BL/6黑色小鼠中这些载有DOX的树状磁性纳米颗粒的生物分布和生物相容性。

图 3.合成PAMAM-Fe3O4-DOX三元组的合成步骤及其在pH-应答的药物递送中应用的图解。13
脂质包被的介孔磁性纳米组装体
在生物医学应用中,基于脂质的囊泡引起了广泛的兴趣。它们可调整的组分、大小、化学性质和药物封装能力使脂质成为递送载体的首选。Nappini及其同事的研究结果表明,低频交变磁场可以作为外部刺激来释放脂质包被的磁性纳米颗粒中的药物分子29。Park和合作者已经将基于透明质酸的脂质体与商用马根维显结合为一个平台,用于乳腺癌细胞中阿霉素的递送和肿瘤MRI30。事实上,在基因递送中使用磁性脂质体也有报道。最近,Jiang和其合作者已经使用胆固醇和基于1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(DSPC)的脂质体封装氧化铁纳米颗粒,用来递送gWiz-GFP质粒DNA编码的绿色荧光蛋白(GFP)31 。我们的团队研发了一种新型的pH和热敏药物递送系统,该系统由封装有介孔磁铁矿纳米组装体(LMMNA)的薄脂质( 货号P0763)层组成(图4)。这些LMMNAs能够同时携带和递送两种抗癌药物,即亲水性阿霉素盐酸盐(DOX)和疏水性紫杉醇(TXL)14 。这种混合系统在AMF之下也可作为加热平台,并具有非常高的加载效率。当两种药物在宫颈癌(HeLa)、乳腺癌(MCF‑7)和肝癌(HepG2)细胞中同时递送时,体外实验显示了细胞毒性效应的改善。由于同时进行热疗和化疗,AMF应用10分钟后显著提高了细胞杀伤效率。

图 4.A) pH和热敏性LMMNA作为含阿霉素(DOX)和紫杉醇(TXL)的双重药物递送系统的图示。通过施加于肿瘤细胞的交变磁场触发药物释放。(B) 体内生物分布和通过荧光成像控制的热化疗研究。14
目前正在研究LMMNA作为双重药物递送系统,通过荧光生物成像用皮下植入肿瘤的裸鼠进行体内生物分布和热化疗的研究。这些非靶向纳米颗粒的生物分布正在非肿瘤裸鼠中进行研究,通过光学荧光成像和不同重要器官中Fe浓度的测量。生物分布的研究表明脂质包被的磁性纳米颗粒在大肠、肺、肝、脾和胃中的积累比在肾和心脏中更多。由于器官摄取LMMNA-DOX:TXL而导致的肿瘤消退也通过生物发光成像以及重复荧光成像来监测。目前正在研究使用交变磁场与双重化学疗法的联合疗法来对抗小鼠模型中的肿瘤。
总结和未来前景
多功能铁磁流体是生物医学应用中研究最集中的功能纳米材料之一。外部磁场操纵纳米颗粒的潜力已经增强了其在靶向化学治疗、癌症的诊断和成像方面的个体优势。多功能化铁磁流体可以改进癌症治疗和疾病管理。多功能铁磁流体的研究已从体外初步研究转向有前景的体内研究阶段。
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?