逆加成-断裂链转移 (RAFT)聚合
简介
RAFT(可逆加成断裂链转移)聚合是一种可逆的去活化自由基聚合(RDRP),是给自由基聚合赋予活性的通用方法之一。1-7本文概述了RAFT聚合在CSIRO的历史发展。1RAFT聚合的优势包括:
- 能够控制大多数可通过自由基聚合反应而聚合的单体的聚合。其中包括(甲基)丙烯酸酯、(甲基)丙烯酰胺、丙烯腈、苯乙烯、二烯和乙烯基单体。
- 耐受单体和溶剂中的无保护官能团(例如:OH、NR2、COOH、CONR2、SO3H)。聚合反应可以在水性或质子性介质中进行。
- 适用于多种反应条件(例如:散装、有机或水溶液、乳液、细乳液、悬浮液)。
- 相对于竞争对手的技术,操作简单,价格低廉。
在理想的活性聚合中,所有的链都在反应开始时被引发,以相似的速率增长并持续参与聚合:没有不可逆的链转移或链终止。如果相对于链增长而言引发较快,那么分子量分布将非常窄,并可通过进一步向反应中添加单体来延长链。在自由基聚合中,不是所有的链都能同时活化。在 RDRP(如 RAFT 聚合)中,如果存在能够可逆地使增长自由基去活化以使大部分活性链保持在休眠形式的试剂,并且反应条件支持活性链与休眠链之间的快速平衡,则将表现出以上特性(图1)。
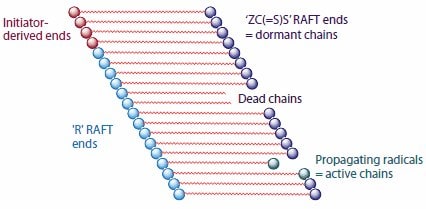
图 1.RAFT聚合示意图。4此处显示的各种链的数量与合理设计的实验所需的数量并不成比例。平均来看,因为相对于增长而言休眠链与活性链端的平衡较快,故所有的活性链都同时增长并且链长度相同。RAFT剂用“ZC(=S)S”表示。
在这些条件下,分子量可以随转化率线性增加,分子量分布可以非常窄(图2),并且多数聚合产物应当由休眠链组成。
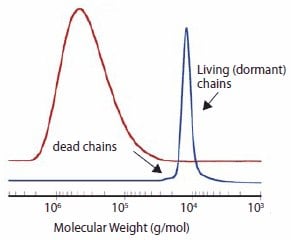
图 2.相似实验条件下苯乙烯的常规聚合和RAFT聚合的典型分子量分布。4
图3显示了RAFT中的链活化/去活化机理。与RAFT平衡相关的反应不止常规自由基聚合中发生的那些(即,引发、增长和终止)。在理想的RAFT过程中,RAFT试剂应该表现出转移剂行为。终止不受RAFT过程抑制。聚合产物中保留的硫代羰基巯基是RAFT聚合反应具备活性的原因,并使得该方法适于合成嵌段共聚物和末端官能化聚合物。某些应用可能需要去除或转化硫代羰基巯基。人们已经设计出了许多去除端基的方法,它们可容易地用于聚合物合成。10, 12-16
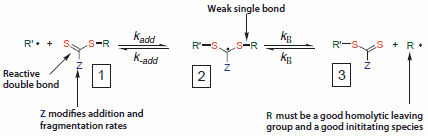
图 3.可逆加成断裂链转移(RAFT)的机理
选择适合于单体的RAFT剂(ZC(=S)SR)和适当的反应条件,对于RAFT聚合实验的成功与否至关重要。但这不应该是件困难的事。RAFT试剂的有效性取决于取代基R和Z,并且已经提出了选择指南(图3)。1,3使用仅有的两类RAFT剂中的一类,即可有效控制大多数单体的聚合反应,以使聚合阻滞最小化,并提供高比例的活性链。第一类试剂适用于甲基丙烯酸等活性较高的单体(MAM),例如甲基丙烯酸甲酯(MMA,货号M55909)、甲基丙烯酸(MAA,货号155721)、羟丙基甲基丙烯酰胺(HPMAM),以及丙烯酸类,例如丙烯酸甲酯(MA,货号M27301)、丙烯酸(货号147230)、丙烯酰胺(AM,货号148660)、丙烯腈(AN,货号320137)、苯乙烯(St,货号W323306)。第二类RAFT试剂适用于活性较低的单体(LAM),例如乙酸乙烯酯(VAc,货号V1503)、N-乙烯基吡咯烷酮(NVP)或N-乙烯基咔唑(NVC)。最近,已有文章介绍了可用于控制MAM和LAM聚合的可切换RAFT试剂。8,9如对末端官能团或聚合物结构有特殊要求,则可能需要使用其他RAFT试剂。10,11
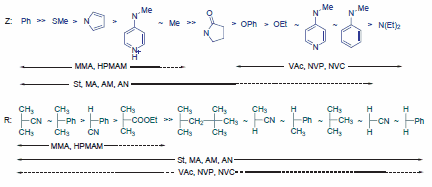
图 4.用于不同聚合反应的RAFT剂(Z-C(=S)S-R)的选择指南。1,3对于'Z',加成速率和转移常数从左至右减小,而断裂速率增大。对于'R',断裂速率从左至右减小。虚线表示受限的控制(例如:阻滞、高分散度等)。
在选择了合适的试剂和聚合条件后,RAFT聚合可用于合成明确的均聚物、梯度聚合物、二嵌段聚合物、三嵌段聚合物和星形聚合物,以及更复杂的结构,包括微凝胶和聚合物刷。目前报道的应用包括新型表面活性剂、分散剂、涂料和粘合剂、生物材料、膜、给药介质、电活性材料和其他采用纳米技术的领域。
“活性较高的单体”(MAM)的RAFT聚合
在使用三硫代碳酸酯(Z = S-烷基,如 4-6)的情况下观察到MAM聚合受到良好控制。Z优选基于低挥发性硫醇。芳族二硫酯(Z = 芳基,如 9, 10)属于活性最高的RAFT剂,在MAM的聚合中具有通用性1,2。然而,在高浓度下使用时,芳族取代的RAFT剂可能引起聚合阻滞,并且易发生路易斯酸诱导的水解和分解。17,18如果担心水解,则可尝试烷基取代的RAFT剂 (4-6)。二(硫代羰基)二硫化物7和8可用作第三类RAFT剂的前体,并可用于在聚合过程中原位形成 AFT剂。19
相对于增长自由基,R必须有效地再引发聚合反应,并且必须是良好的均裂离去基团。20R还必须高效再引发聚合反应,相对于增长速率它应该被快速加入单体中。丙烯酸酯和丙烯酰胺的优选是R = 氰甲基的RAFT剂6。在甲基丙烯酸酯情况中,“R”的选择至关重要。在一些最有效的RAFT剂中,R为叔氰烷基(例如 4、5、9)。以下甲基丙烯酸甲酯 (MMA) 的RAFT聚合示例显示了RAFT方法的实用性。采用 1,1’-偶氮双(1-环己烷甲腈)引发剂以及浓缩约60倍的S-十二烷基S-(2-氰基-4-羧基)丁-2-基三硫代碳酸酯5,在 90°C 下进行一系列高转化率 (80-100%) MMA 聚合。10图5 中显示了6小时后观察到的分子量分布。分子量范围为2,600至125,000,与根据所用RAFT剂和引发剂的浓度的预期相符。10所有样品的分子量分布均较窄 (PDI <1.2)。
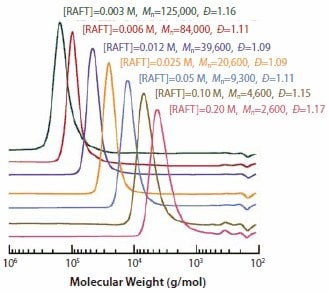
图 5.使用1,1’-偶氮双(1-环己烷甲腈)(0.0018 M)作为引发剂以及不同浓度的RAFT剂5,在90°C下进行6小时的MMA(6.55 M的苯溶液)高转化率RAFT聚合所形成的PMMA的分子量分布。10
“活性较低的单体”(LAM)的RAFT聚合
Z = NR’ 2(二硫代氨基甲酸酯)、Z = OR’(黄原酸酯)以及 R’ = 烷基或芳基的活性较低的RAFT剂可提供良好的聚合控制。Z = R(二硫酯)或 SR(三硫代碳酸酯)的活性较高的RAFT剂会抑制LAM的聚合。因为大多数同类单体都具有高增长速率常数,所以 R 基团的选择也同样重要。对于12和13等RAFT剂,由于再引发较慢,预计存在抑制期。一种优选的RAFT剂为11。11的VAc聚合实例见表1。7
可切换型RAFT剂
最近,我们报道了一类新的刺激响应型RAFT剂,它们可以“切换”,对MAM和LAM的聚合都能提供良好地控制,并因此提供了更便捷的途径生成分子量分布较窄的聚MAM-嵌段-聚LAM聚合物。9此方法通过使用4-吡啶基-N-甲基二硫代氨基甲酸酯衍生物制备PMMA-嵌段-PVAc和PMA-嵌段-PNVC.得到证明。N-4-吡啶基-N-甲基二硫代氨基甲酸酯可有效控制LAM的聚合(图),质子化后还能极好地控制MAM的聚合。9
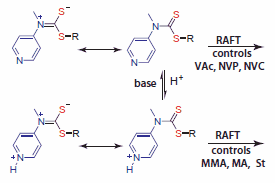
图 6.能够在pH控制下聚合LAM和MAM的RAFT剂。
结论
可逆加成断裂链转移 (RAFT) 已成为控制自由基聚合的最重要方法之一。RAFT已被证明稳健、通用,适用于易发生自由基聚合的大多数单体。然而,选择适用于单体的RAFT剂连同合适的反应条件对于聚合反应的成功与否至关重要。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?