在 AAW™ 自动工作站上使用 PureProteome™ 镍磁珠自动纯化 HIS TAG® 蛋白质
当分析数百个新生成的突变体时,筛选重组标记蛋白的表达是一项具有挑战性的任务。 本方案指导如何以高通量(96 孔)方式自动裂解、提取和纯化 HIS 标记突变体。请阅读下面的详细信息。

HIS TAG® 蛋白纯化自动化简介
我们经过验证的自动化方案可在 2.5 小时内使用镍-HIS 结合磁珠纯化 96 孔细胞样本,完全无需动手*。96孔板中分离得到的蛋白质可以通过多种方法进行进一步分析,包括毛细管电泳(CE)、液相色谱-质谱联用(LC-MS)或其他高通量检测方法。
PureProteome™镍磁珠具有相对较高的结合能力(1-5 µg 蛋白/mL 磁珠悬浮液)和耐用的磁珠类型(硅胶磁珠),因此是自动纯化的上佳选择。将这些珠子与 CelLytic™ B 试剂或 BugBuster® 母液等裂解溶液配对,可产生一种高效的裂解和捕获方法,非常适合由 Opentrons® 提供支持的 AAW™ 系统。
PureProteome™ 用户指南协议已被改编成 Python 代码并经过测试,可通过 Millipore® 协议库获取。下载到仪器后,它可用于执行所有液体处理步骤,包括一步裂解和捕获、三步洗涤和两步洗脱,包括所有甲板上振荡和磁力下拉捕获。
*除非在两步洗脱过程中添加暂停,以控制溶解试剂起泡。 见下文。
硬件
- AAW™ 自动移液工作站(Prod.999-00241)
- AAW™ 8 通道移液器,1,000 μL(Prod.No. 999-00245)
- AAW™ 8-通道移液器,50 μL (Prod.No. 999-00247)
- Opentrons Flex™ Magnetic Block (Prod.No. 999-00204, cone configuration) or Mag Plate Assembly (Prod. No. 90-0003-02, ball configuration)
- AAW™ Flex Gripper (Prod.999-00244)
- Opentrons Flex™ 加热振动器(获取报价)
- Opentrons Flex™ Deck Expansion (4pk) (Prod.No. 999-00203)
- PureProteome™ Magnetic Stand, 15mL (Prod.LSKMAGS15)
PureProteome™ 协议上传和 AAW™ 工作站设置
新用户在运行协议前应通读此文。有关向 AAW™ 工作站加载协议的详细说明,请参阅 AAW™ 用户手册。但为简便起见,我们在此提供了指导说明。
AAW™移液工作站已被编程用于自动分离 6His 标记的蛋白质(请参阅 PureProteome™镍磁珠系统的用户指南)。要为该蛋白纯化应用准备仪器,用户只需按照屏幕上的提示操作即可。
- 要在 AAW™ 工作站上加载程序,首次运行程序需要用户从 Millipore®协议库下载协议文件。然后,在电脑上下载 Opentrons® 应用程序。最后,通过 Wi-Fi 或以太网线连接,建立对您的 AAW™ 工作站的访问
- 一旦协议下载到电脑,您就可以使用 "导入"(在右上角)将协议加载到 Opentrons® 应用程序中。从这里有几个选项可将协议加载到 AAW™ 工作站上。可以按照协议右侧菜单中的选项,选择“发送到 Opentrons FLEX”或“开始设置”。反之,您可以点击协议列表中的名称 "His-tagged Protein Purification by PureProteome™ Nickel Magnetic Beads with Lysis Buffer",然后选择"Start setup"按钮。
- 选择 AAW™ 设备并"发送"后,您可以转到触摸屏(选择已加载的协议并进行上述设置),也可以使用计算机并开始选择下列参数。
- 干运行:是或否(默认为否)。选择“是”允许用户在不消耗试剂或吸头的情况下快速测试程序。
- 暂停离心(默认为否):暂停以合并气泡液体(请参阅下文"开始前的注意事项"部分)
- *CelLytic™ B 试剂的列数(默认为 6):可以是 0-12。
- *用于 BugBuster® 母液的列数(默认为 6):必须添加到<12。请参阅下面的注释。
- 磁体类型:球形配置或锥形配置(默认为球形)
- P1000_8 通道安装:左侧或右侧(默认为左侧)
*注意:如果 3c +3d 大于 12,将返回以下错误:
"协议分析失败
在您的计算机上尝试分析 Protein PureProteome 时发生错误。请修复以下错误并尝试重新运行此协议。
Exception [line 123]:无效列号"
完成参数设置后,点击"确认值"。
- 仪器。清理机器人平台,安装附件(移液管和抓手)。按照屏幕上的说明,安装 AAW™ 8 通道移液器,1,000 μL,AAW™ 8 通道移液器,50 μL(按步骤 2b 中所选的位置放置)以及 AAW™ Flex 抓扳手,然后继续按照触摸屏或 Opentrons® 应用程序上的说明逐步操作。根据需要校准移液器和抓扳手,同样按照屏幕提示(或 AAW™ 用户手册中的信息)进行。成功安装和校准后,三个附件都将标为绿色。完成后,点击左上角的“<”返回到下一步。
- 甲板硬件。按照屏幕上显示的甲板位置(以及下面列出的位置),将模块和夹具装入指定位置,包括加热器振动器、垃圾箱和两个甲板扩展器。确保加热-振荡器已插好电源、开启,并且在应用程序或触摸屏模块中可见。
- 加热器-振动器。取下 D3 中的甲板,将加热器-振动器模块安装到载体中。将组件下放到甲板位置并拧紧螺丝之前,确保电源和 USB 电缆已插入,且按下电源按钮时指示灯亮起。根据仪器说明,按需进行校准。
- 垃圾箱。卸下 A3 的甲板,固定(环形)托架和垃圾箱。
- 中转区插槽(两个)。拆下 B3 和 C3 处的甲板板,换上右手甲板扩展器(保留左上角的蓝色实验室器皿夹)。
完成后,显示器应显示已连接2个夹具和1个模块,并且它们应被高亮显示为绿色。
- 实验室器皿位置检查这可以在实验室器皿放置在平台上后完成(参见 "8.实验室器皿 "部分),也可以一次完成一件。如果协议最近没有运行过,很可能需要进行实验室器皿位置检查。这可以使用校准探针和屏幕或计算机按键/命令将探针移动到 0.1 毫米以内的位置,从而准确定位甲板上的每个实验器皿单元(如储液器、平板、磁铁单元和移液器)。第一次运行将是一次学习经历,但请按照屏幕上的说明和《AAW™ 用户指南》进行操作。
完成后,选择"更新偏置"和"确认偏移值"。如果最近完成了 Labware 位置检查,您可能希望接受以前的偏置,只需点击"确认偏置"即可,无需更改或检查。 - 参数应已按步骤 3 设置。
- 实验器皿必须将所有塑料器皿、移液器吸头和磁性装置放在平台上。完成后,平台应按下图所示加载。选择"确认放置"。
平台的设置应如下图 1 所示。

图 1.PureProteome™ 镍磁珠系统的工作台配置图。实验室器皿和硬件位置的 AAW™ 平台设置配置示意图。
- 液体。触摸屏将显示所需体积,同时考虑到要使用的平板柱数量。本方案所需的试剂可按照 PureProteome™ 用户指南进行配制,简要步骤如下。
- 使用 15 mL 的 PureProteome™磁力架配制磁珠。用一份浆液和三份溶解试剂混合微珠。将所需的磁珠液体积(磁珠占裂解液总体积的 1/4)加入 15 mL 试管中,然后用等体积的洗脱缓冲液(如下所述)洗涤。旋转混合 1 分钟,然后在磁铁上沉淀 2 分钟,取出上清液,加入等体积的裂解试剂(如 CelLytic™ 或 BugBuster® 试剂),混合,取出,时间如上。然后按照《PureProteome™用户指南》的要求加入溶解试剂使其成为最终液体积(即 4 倍添加的磁珠液),并加入溶解酶、Benzonase®核酸酶和蛋白酶抑制剂鸡尾酒。
- 可按照《PureProteome™用户指南》的要求配制洗涤缓冲液:50 mM 磷酸钠、300 mM NaCl、10 mM 咪唑 pH 8.0。
- 可根据《用户指南》配制洗脱缓冲液:50 mM 磷酸钠,300 mM NaCl,300 mM 亚胺唑 pH 8.0。
- 按照"开始前的注意事项"一节中的描述制作冷冻细胞沉淀。
试剂应添加到下图 2 所示的 12 孔储液器中,放置在平台位置 C3。
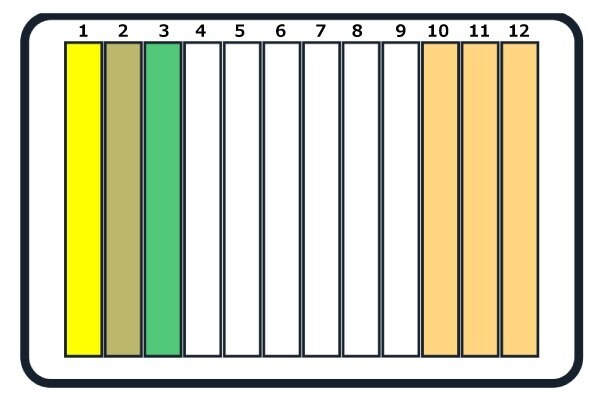
图 2.将试剂放入 12 槽储液器。1.Bead + lysis buffer (CelLytic™ B reagent), 2. Bead + lysis buffer (BugBuster® mix), 3. Elution buffer, 10.洗涤缓冲液 1,11.洗涤缓冲液 2 和 12.洗涤缓冲液 3。
注意:干运行只需在10号槽中添加一次洗涤缓冲液。
在此步骤中将显示所需的试剂体积。 下表 1 显示的是一个 5 列 CelLytic™ 和一个 5列 BugBuster® 的运行示例。
一旦完成步骤 1-9,并确定所有物品都已放置妥当,关闭机器人外壳,到屏幕顶部选择"运行 (>)"。
AAW™ 工作站将加入细胞裂解液和珠子,振荡 30 分钟,去除未结合部分,执行三次单独的洗涤(加入洗涤缓冲液、振荡、捕获、去除上清液),最后执行两个洗脱步骤*。输出结果将是一个位于 D1 位置的 96 孔板,每孔含有组合洗脱液(30 μL),与最初放置在细胞浆起始 96 孔板中的一样。
*除非在两个洗脱步骤中添加一个暂停,以控制溶解试剂起泡。见上文。
一些纯化的蛋白质可能会有少量的珠子残留。这可以通过将磁珠固定在平板磁架上,然后手动将材料移入适合下游分析的干净平板中来去除。
纯化的蛋白质现在可以根据需要进行检测。用户必须注意,高浓度的咪唑会影响一些常见的检测。在 A280 条件下测量蛋白质会有很高的背景,许多蛋白质检测也是如此。可以考虑用Bradford 试剂进行蛋白质浓度测定(产品编号:B6916),因为它可以通过稀释进行高咪唑测定。其他方法,如毛细管电泳、液相色谱法、液相色谱/质谱法或活性测定法都是定量的好方法。
自动化蛋白质纯化与手动纯化结果对比
本方案使用根据《PureProteome™ 用户指南》进行的蛋白质纯化进行了测试,通过手动纯化和使用上述 AAWTM 工作站上的改良方案。在不同的仪器上使用不同的磁块重复检测 3 次。检测的所有步骤都在仪器平台上进行。使用 Revvity® LabChip GXII Touch™ 毛细管电泳系统测定每个样品(孔)的纯度和产量。
注:Revvity®是 Revvity, Inc.的注册商标。
为了评估手动方法与 AAW™ 方法的等效性,使用了球形磁铁。手动方法的平均值为 62.7 μg/孔,StDev 为 27.4,而 AAW™ 方法的平均值为 55.3 μg/孔,StDev 为 20.1。通过 2 样本 t 检验显示,这两组在统计学上没有区别。结果如图 3 所示。
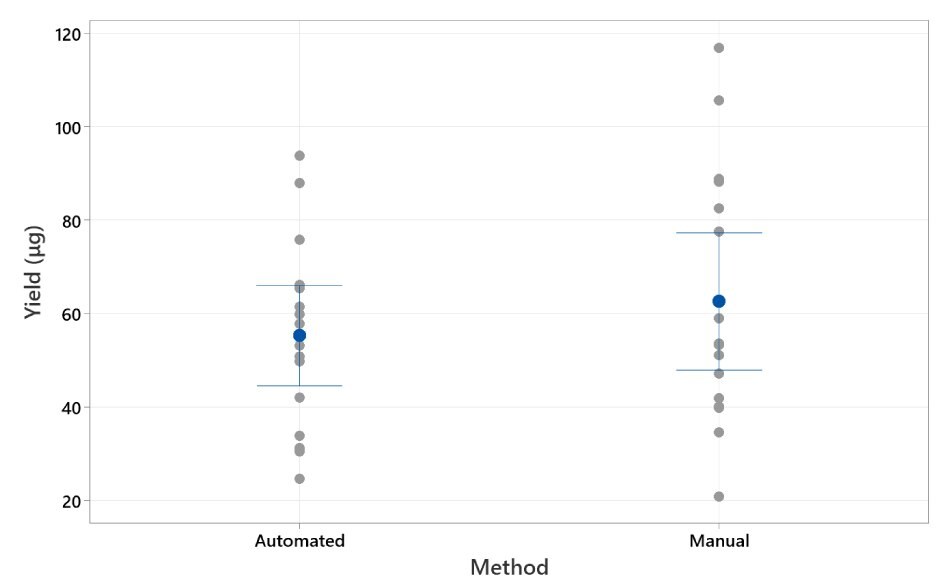
图 3.产量(微克)的单值图。单个点阵图显示手动和 AAW™ 自动方法的产量。显示的晶须范围为标准偏差。平均值的 95% CI。
本方案是使用八种 N 末端 6His 标记的蛋白质和 CelLytic™ B 试剂(按建议添加)或 BugBuster® Master Mix 溶液开发和测试的。用于比较各种测试方法性能的关键参数是蛋白质产量。在十六种条件(蛋白质和裂解液)中,每种条件都有六个重复。结果表明,使用 PureProteome™ 蛋白纯化方案的 AAW™ 工作站在不同的 大肠杆菌构建体中都能获得可重复的结果。CelLytic™ 试剂的产量显示,八种构建体的 %CV 为 7-18.5%,平均纯度为 89%。BugBuster® 混合试剂的产量差异较大,%CVs 为 11-41%,平均纯度为 95%。通过在 Revvity® GX II 系统上进行毛细管电泳测定,裂解系统在蛋白水解和产量方面表现出依赖蛋白质的差异。见表 2。
对自动和手动方案进行的进一步比较表明,AAW™ 系统提供的产量和纯度在测量误差范围内与有经验的手动用户得出的值无异。实验在两台不同的 AAW™ 仪器上进行,每台仪器使用两种构建体(样品 3 和 8)各八个样品。该协议使用两种类型的磁铁(球形配置和锥形配置)进行开发和测试。锥形磁铁的产量大约是球形磁铁的一半,但大肠杆菌构建体的相对产量保持不变,如表 3 所示。这可能是由于球形磁铁的承载能力更大,使得在三个洗涤步骤中损失的珠子更少。
开始运行前的注意事项
在运行基于细胞的蛋白质纯化之前,必须考虑实验流程的容量以及从预期纯化蛋白质产量中获得的信息。在此方案中:
- 选择了标准高度的 96 孔板,Axygen V-bottom检测板,因为孔容量大(450 µL)且板底为 V 形。
- 通过滴定稀释的磁珠、用磁铁将其吸下并去除多余的液体来设置每孔的磁珠量。超过磁铁容量的体积(见于废物中过量*的磁珠)或溢出到孔底的泥浆量(阻碍液体清除)被认为是不理想的。对于我们的球形磁力板,每孔的最大磁珠量为 25 µL PureProteome™ 泥浆。Opentrons® 磁力架的容量大约是该体积的一半
- 使用毛细管电泳系统(Revvity® GXII Touch)或 Bradford 蛋白质测定法测量产量。这两种方法都需要小量(2-5 µL)至少 200 µg/mL 蛋白质才能获得可靠的信号;每孔的最终用量为 30 µL。
*注意,在从磁珠移除液体的过程中,几乎总会有一些磁珠损失。
此外,重要的是要测试您的表达系统,以确定能使磁珠饱和的细胞量,并确定使用 <450 µL 最终细胞悬液中的细胞是否能检测到蛋白质。在这项工作中,BL21-A1、araC(pBAD)表达系统效果很好,因为它是可诱导的,经过 18°C 长时间的最终培养后,可获得较高的最终培养密度。测试中使用的 8 个构建质粒收获时的 A600 在 9-12 OD 之间。测试表明,使用相当于 3.6 OD 的体积(如 360 µL 的 10 OD/mL 悬浮液),推荐的最大珠子体积可获得 90% 的回收率。将细胞悬浮液孔板以 1xkg 的速度旋转 15 分钟后,将倒置的平板放在铺有纸巾的工作台上轻轻拍打,上清液就会被除去,每孔留下约 20 毫克的细胞团块。仔细滴定细胞量可以更好地比较产量,因为研究人员可以对输入量进行归一化处理,或在纯化后进行校正。
用于蛋白提取的最佳细胞悬液用量会因您的系统而异。一旦确定了在此过程中使用的细胞培养量,您就可以制作装满材料的 96 孔板进行处理。如果不立即使用,请将装有细胞团块的平板保存在 -80 °C。
最后,如果需要进行一些实验,程序中内置的一些功能会有所帮助。
- 程序允许运行少于一个平板,用户可以选择包含的平板列数(8、16、24、32....96 样品)。样品(列)数量的改变会导致试剂量的改变,显示在设置的液体试剂部分。
- 如果需要测试或优化裂解方法,可将裂解/珠子拆分,以测试两种条件。用户可以选择可用于比较一种磁珠微珠/裂解系统(如 CelLytic™ 试剂)和另一种系统(如 BugBuster® 混合液)的平板列柱数量。
- 最后,如果使用的是起泡裂解液(如 BugBuster® 混合液),用户可以选择在加入洗脱缓冲液后暂停。这一步出现的气泡会导致转移效率低下,重复的百分比CV值偏高。这可以通过在洗脱的振荡部分之前进行离心来缓解。暂停需要用户在程序运行时间的最后四分之一进行干预。
如要继续阅读,请登录或创建帐户。
暂无帐户?