Primary Cell Culture Basics
- What Are Primary Cells?
- Primary Cells vs. Cell Lines
- Primary Cell Culture Applications
- Primary Cell Culture Tips and Tricks
- Related Products
What Are Primary Cells?
Primary cells most closely represent the tissue of origin. They are taken directly from the tissue and processed to establish them under optimized culture conditions. Because they are derived from tissue and not modified, they are more similar to the in vivo state and exhibit normal physiology. For this reason, they provide excellent model systems for studying the normal physiology and biochemistry of cells (e.g., metabolic studies, aging, signaling studies), and the effects of drugs and toxic compounds on the cells. Keep in mind that primary cells have a limited lifespan and will stop dividing (or senesce) after a certain number of cell divisions and can be more difficult to culture and maintain than a continuous cell line. The variability induced in primary cells acquired from donors and during subculture practices is a major challenge faced by the researchers who study cell signaling pathways. Researchers prefer to screen the cells for sensitivity to common stimuli before embarking on signaling studies. Pre-screened primary cells save valuable resources as they are stimulated for activation of major signaling pathways.
The most popular types of primary cells used in research are epithelial cells, fibroblasts, keratinocytes, melanocytes, endothelial cells, muscle cells, hematopoietic and mesenchymal stem cells. The cultures are initially heterogeneous (represents a mixture of cell types present in the tissue) and can be maintained in vitro only for a limited period of time. Primary cells may be manipulated for indefinite subculture through an in vitro process called transformation. Transformation can occur spontaneously or can be chemically or virally induced. When a primary culture undergoes genetic transformation (provided with appropriate fresh medium and space), they divide indefinitely and become an immortalized secondary cell line.
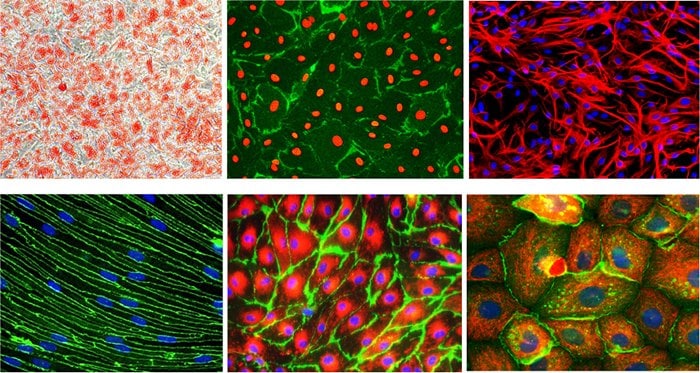
Figure 1.Examples of commonly used primary cells used in biomedical research.
Primary Cells vs. Cell Lines
Continuous cell lines have acquired the ability to proliferate indefinitely (immortalized) either through random mutation as in transformed cancer cell lines, or by deliberate modification such as artificial expression of cancer genes. Continuous cell lines are generally more robust and easier to work with than primary cells. They have unlimited growth potential and are a quick, easy way to get basic information. Some drawbacks to working with continuous cell lines is that they are genetically modified/transformed, which can alter physiological properties and not represent the in vivo state, and this can further change over time with extensive passaging.
Primary Cell Culture Applications
Primary cell culture is increasingly being used as a major tool in cellular and molecular biology, providing excellent model systems for studying the normal physiology and biochemistry of cells (e.g., metabolic studies, aging, signaling studies), the effects of drugs and toxic compounds on the cells and mutagenesis and carcinogenesis. It is also used in drug screening as well as for the development of biological compounds (such as: vaccines, therapeutic proteins) on a large scale.
- 3D Cell Culture: Since primary cells are non-transformed and non-immortalized they closely simulate a living model, yield more physiologically significant results and can be used to model 3D tissues. These cells can act as a model system to study cell biology and biochemistry, to study the interaction between cell and disease-causing agents (like bacteria, virus), to study the effect of drugs, to study the process of aging, to study cell signaling and metabolic regulations. In many cases the use of primary cells allows the researchers to avoid the complications (availability, cost and ethics) involved in using animal models.
- Cancer Research: Primary cells can be exposed to radiation, chemicals, and viruses to make them cancerous. Thus, the mechanism and cause of cancer and the altered signaling pathways can be studied. It can also be used for determination of effective drugs for cancer cells. The side effects of cancer treatments (chemotherapy and irradiation) on normal cells can also be studied in this context.
- Virology: Detection, isolation, growth, and development cycles of viruses can be studied. Primary cells are also useful to study the mode of infection.
- Drug Screening and Toxicity Testing: Primary cell cultures are used to study the cytotoxicity of new drugs (to study the effect and safe dosage) and/or drug carriers (nanoparticles). It is useful for the synthesis or production of a variety of biomolecules at an industrial scale. This is particularly useful in the pharmaceutical industry. Various research projects on cell-based therapeutic products, using primary cells are being developed. Primary culture is used as an alternative for animal models to test the effects of new drugs, cosmetics and chemicals. They are also used to determine the maximum permissible dosage of new drugs.
- Vaccine Production: Primary animal cells are used in the production of viruses and these viruses are used to produce vaccines (such as vaccines, for deadly diseases like polio, rabies, chicken pox, measles and hepatitis B are produced using animal cell culture) thus avoiding the use of animal models.
- Genetic Engineering: Primary cell cultures are used to produce commercially important genetically engineered proteins such as monoclonal antibodies, insulin, hormones, and much more.
- Tissue or Organ Replacement: Primary cell cultures can be used as replacement tissue or organs. Research is on-going on utilizing primary cells in the reconstruction of damaged tissue or replacement of non-functional cells or tissues. Organ culture techniques and research are being conducted on both embryonic and adult stem cell culture. These cells have the capacity to differentiate into many different types of cells and organs. By controlling the development and differentiation of these cells, we may be able to treat variety of medical conditions. Primary cells have also been used extensively in 3D bioprinting applications.
- Stem Cell Therapy: Stem cells isolated from bone marrow, blood or embryo involve primary cell culture. A patient’s own stem cells or those from a donor are grown in vitro for generating enough cells that may be used to regenerate tissue or replace functionally deficient cells. This is an area that is being explored to design therapies for genetic disorders, spinal cord injuries, degenerative diseases, and cancer.
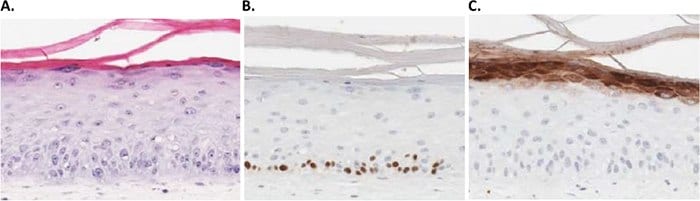
Figure 2.3D human skin models can be used as an alternative to animal testing for the cosmetics industry. A) H&E B) BrdU and C) Filaggrin staining of a 3D skin model using primary human dermal fibroblasts, keratinocytes and melanocytes.
Primary Cell Culture Tips and Tricks
Growth Requirements
Primary cells can be grown either in suspension or adherent cultures. Some cells naturally live in suspension, without being attached to a surface (for example those derived from peripheral blood). There are also cell lines that have been modified to be able to survive in suspension cultures; they grow to a higher density than adherent conditions would allow. For the primary cells that are anchorage-dependent, adherent cells (such as solid tissues) require a surface to grow properly in vitro. These cells are mostly cultured in a flat un-coated plastic vessel, but sometimes a micro-carrier, which may be coated with extracellular matrix proteins (such as collagen and laminin) to increase adhesion properties and provide other signals needed for growth and differentiation. The cell culture media is composed of a basal medium supplemented with appropriate growth factors and cytokines. Cells are grown and maintained at an appropriate temperature and gas mixture (typically, 37 °C, 5% CO2 for mammalian cells) in a cell incubator. The culture conditions widely vary depending up on the cell type. Growth media can vary in pH, glucose concentration, growth factors, and the presence of other nutrients depending up on the cell types.
During establishment of primary cultures, it is essential to include an antibiotic in the growth medium to inhibit contamination introduced from the host tissue. Antibiotics may include a mixture of gentamicin, penicillin, streptomycin and amphotericin B. However, long-term use of antibiotics is not recommended, since some reagents (such as amphotericin B) may be toxic to cells on a long run.
It is very important to retain the viability of primary cells after isolation as most of them undergo the process of senescence and stop dividing after a certain number of population doublings. For long-term viability of the cells excellent cell-culture handling skills along with appropriate culture condition (i.e. growth medium, temperature, gas mixture, pH, growth factors concentration, presence of nutrients and glucose) are essential. Growth factors used to supplement media are often derived from animal blood (the blood-derived ingredients possess the potential for contamination) it is recommended to minimize or eliminate the use of these ingredients wherever possible. Use of aseptic technique is also necessary.
Cellular Confluence
Cellular confluence generally refers to the percentage of the culture vessel inhabited by attached cells. For example, 100% cellular confluence means the surface area is completely covered by cells, whereas 50% confluence means roughly half of the surface is covered. It is an important and essential parameter to track and assess in primary cell culture as various cell types require different confluence end points, at which point they need to be sub-cultured.
Maintenance and Subculture
The maintenance phase of cells begins when isolated cells are attached to the surface of the culture dish. Usually attachment takes about 24 hours after initiation of the culture. When cells reach a desired percent of cellular confluence and are actively proliferating, it is time to subculture. It is the best time to subculture primary cell cultures before reaching 100% confluence, since post-confluent cells may undergo differentiation and exhibit slower proliferation after passaging.
Anchorage-dependent cells grow in monolayers and need to be sub-cultured at regular intervals with appropriate culture medium to maintain exponential growth. Sub-cultivation of monolayers involves the breakage of both inter- and intracellular cell-to-surface bonds. Most adherent primary cells require the digestion of their protein attachment bonds or separation from the monolayer or relevant tissue with a low concentration of a proteolytic enzyme such as trypsin/EDTA. After the cell dissociation and dispersion into a single-cell suspension, they are counted and diluted to the appropriate concentration and transferred to fresh culture vessels (the composition of the media varies depending up on the cell types) where they will reattach and divide.
Cell Counting
Hemocytometers are commonly used for estimation of cell number and determination of cell viability using the exclusion dye Trypan Blue. A hemocytometer is a fairly thick glass microscope slide with a rectangular indentation that creates a chamber. The chamber is engraved with a laser-etched grid of perpendicular lines and the device is carefully crafted. The area bounded by the lines and the depth of the chamber is known. Therefore, it is possible to count the number of cells in a specific volume of fluid, and thereby calculate the concentration of cells in the fluid overall.
Cryopreservation and Recovery
Cryopreservation is the process to preserve structurally intact living cells using low temperatures. It is essential to cryopreserve and thaw primary cells in order to minimize cell damage and death during each process. In case of primary cells it is achieved with the use of a cryoprotectant, such as DMSO or glycerol (at correct temperature and with a controlled rate of freezing). Cryopreservation can be achieved in a mixture of 80% complete growth medium supplemented with 10% FBS and 10% DMSO for most primary cells. The freezing process needs to be slow, at a rate of -1 °C per minute, to minimize the formation of ice crystals within the cells. The frozen culture needs to be stored in the vapor phase of liquid nitrogen (-196 °C), or below -130 °C.
Thawing cryopreserved cells is a rapid process accomplished by immersing frozen cells in a 37 °C water bath for about 1 to 2 minutes. Precaution should be taken not to centrifuge primary cells upon thaw (as they are extremely sensitive to damage during recovery from cryopreservation). It is good to plate cells directly upon thaw, and allows cultures to attach for the first 24 hours.1 When initiating a culture of cryopreserved primary cells, it is essential to remove the spent media once the cells are attached (as DMSO is harmful to primary cells and may cause a drop in post-thaw viability).
Primary Cell Culture Troubleshooting
- Contamination: Contamination of primary tissue when carried over to culture.
- Shifts in pH: This may be caused sue to incorrect salt in the culture medium, bacterial or fungal contamination, insufficient bicarbonate buffering, incorrect carbon dioxide tension etc.
- Optimum adherence: Insufficient or absence of attachment factors in the medium or contamination or overly trypsinized cells.
- Slow growth: Reasons include change in pH of the medium, depletion of essential growth-promoting components/factors, low contamination, improper storage of reagents etc.
- Cell death: Temperature fluctuation, absence of CO2, cell damage during thawing and/or cryopreservation, increase concentration of toxic metabolite, imbalanced osmotic pressure in culture medium result in decrease in the survival of cells.
- Precipitation: (no change in pH): Precipitates in the medium without change in the pH may appear due to use of frozen medium, residual phosphate leftover while washing with detergent, which may precipitate powdered medium components.
- Cell clumping: Suspension cell may clump due to presence of calcium, magnesium ions or due to cell lysis and release of DNA (over digestion with proteolytic enzymes).
- Induced variability: Use of a variety of reagents and media induces variability in data acquired using primary cells. The handling methodology between the users may also contribute to the variability.
Related Products
References
To continue reading please sign in or create an account.
Don't Have An Account?