药物性肝损伤:针对新型肝毒性生物标志物开发多重检测Panel
药物性肝损伤的毒性生物标志物一直在不断增加。通过基于Luminex®微珠多重免疫检测的MILLIPLEX®大鼠肝损伤Panel等多重检测试剂盒,可帮助研究人员同时分析多个肝毒性标志物,节省时间和样品。多重分析还能测量细胞因子水平,关联促炎标志物和肝损伤,加深对肝损伤过程的认识。
什么是药物性肝损伤生物标志物?
药物性肝损伤(DILI)是导致上市药物下线的主要不良反应事件。1肝脏是一种多功能器官。由于药物可通过多种致病机制引起肝损伤,我们需要检测多种生物标志物,保证在药物研发早期就能发现其潜在的肝毒性。2评价药物性肝损伤的传统生物标志物是丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)。但是,不断有组织病理学实验表明这些生物标志物的水平不能准确反应肝损伤。3因此,在与伙伴监管机构的合作下,预测安全性检测协会(PSTC)一直都在研究其他更具预测性的潜在肝损伤标志物。3
利用多重检测试剂盒分析肝毒性生物标志物
通过多重免疫检测试剂盒,研究人员可以同时检测多个肝损伤生物标志物。下列数据描述了一种Luminex®微珠多重免疫检测试剂盒(MILLIPLEX®大鼠肝损伤Panel),可同时检测血液中的下列肝毒性生物标志物:
- 精氨酸酶 1(ARG1)
- α-谷胱甘肽巯基转移酶(GSTα)
- 5'核苷酸酶(5'NT)
- 山梨糖醇脱氢酶(SDH)
- 谷草转氨酶1(GOT1)
这些生物标志物属于肝细胞和肝胆类酶,随着肝损伤发生而释放入血。4
此多重检测Panel的性能评估证明了这一检测方法稳健性,评估指标包括灵敏度(MinDC,12 pg/mL)、特异性(无交叉反应性)、准确度(80–100%回收率和线性)、精密度(分析内<10% CV,分析间<15% CV)和宽广的动态线性范围(3 logs)。用对乙酰氨基酚和硫代乙酰胺诱导的急性肝毒性致中心小叶肝细胞坏死的大鼠模型对检测Panel进行生物学检验。在两种模型中均观察到显著的血液蛋白动力学变化。蛋白基线浓度无法检出;肝细胞毒性发生时大量肝细胞酶释放入血。给药24小时后,观察到峰浓度升高(高达250倍)。酶活性与蛋白浓度存在强关联性,同样检测到大幅提升。约4天内,蛋白浓度逐渐降低并回归正常水平。
同时研究了细胞因子在肝损伤反应中的参与情况。细胞因子可作为潜在的DILI生物标志物。其可能的致病机制是早期肝细胞坏死释放的分子被toll样受体识别,导致促炎细胞因子释放。5.6采用MILLIPLEX® 大鼠细胞因子/趋化因子Panel检测27种细胞因子,发现有8种细胞因子的动力学变化与肝细胞酶生物标志物的变化一致,说明这几种细胞因子确实参与了肝毒性发病过程。
研究结果证明了多重免疫检测试剂盒定量分析多种生物标志物的稳健性和易用性,尤其适合研究人员在转化药物诱导的肝损伤研究中监测生物标志物。
材料和方法
为评估免疫检测试剂盒的性能,首先建立对乙酰氨基酚(APAP)和硫代乙酰胺(TAA)诱发急性肝毒性大鼠模型。在西方国家,对乙酰氨基酚(APAP)过量是导致急性肝功能衰竭的最常见因素。肝细胞损伤的发生主要是由于APAP代谢产物CYP2E1经过生物活化形成的活性中间产物会耗竭谷胱甘肽,并结合关键的细胞大分子。大剂量摄入APAP会诱发大鼠中心小叶肝细胞坏死(centrilobular hepatocyte necrosis),也会导致比例更低的线粒体功能障碍。硫代乙酰胺(TAA)是一种强效的肝毒性物质,经过微粒体CYP2E1介导的2步生物活化反应形成硫代乙酰胺亚砜(TASO),进一步形成活性代谢产物硫代乙酰胺-S,S-二氧化物(TASO2)。这些活性代谢产物可共价结合多种蛋白质,同样也会导致中心小叶肝细胞坏死。
对乙酰氨基酚大鼠肝损伤模型
7-8周龄的雄性SD大鼠禁食过夜后,一次性腹腔注射(IP)对乙酰氨基酚的20% Tween® 80溶液,剂量为1 g/kg。在给药前、给药后24、48和72小时前后时间点,在异氟烷麻醉下,经舌下静脉采血250–300 μL。对乙酰氨基酚给药96小时后,安乐死处死大鼠并采集血样。
硫代乙酰胺大鼠肝损伤模型
7-8周龄的雄性SD大鼠禁食过夜后,一次性IP注射硫代乙酰胺的磷酸缓冲液溶液,剂量为300 mg/kg。给药24小时后,安乐死处死大鼠并采集血样。
样本处理
用检测缓冲液按1:25比例稀释血清或血浆样本,37°C孵育过夜(16-18小时)。
多重检测试剂盒
采用MILLIPLEX®大鼠肝损伤Panel和大鼠细胞因子/趋化因子Panel,根据说明书所述实验方案进行检测。
酶促检测操作步骤
ARG1、GOT1、5'NT、GSTα和SDH酶活性检测试剂盒分别购自我们公司、Crystal Chern、Cayman Chemical和New York University at Buffalo,按照厂商提供的使用说明进行检测。
DILI 多重分析结果
图1显示了Panel每种分析物的标准曲线,通过未给药和对乙酰氨基酚给药大鼠血浆中的生物标志物浓度对应平均荧光强度(MFI)绘制而成。在所有情况下,相比未给药大鼠(“CTRL”),对乙酰氨基酚给药大鼠(“TOX”)的DILI生物标志物浓度升高。

图 1.大鼠对乙酰氨基酚肝损伤模型中的ARG1、GOT1、GSTα、5’-NT和SDH血液蛋白浓度均升高。给药前(“CTRL”)和给药24小时后(“TOX”),每只大鼠采集~250 μL血样,并制备血浆样本。采用MILLIPLEX®大鼠肝损伤Panel定量分析血液蛋白浓度。
图2显示未给药和对乙酰氨基酚给药大鼠血浆样本的酶活性检测结果。对于所有5种酶生物标志物,对乙酰氨基酚给药大鼠每单位样本的酶活均更高。

图 2.ARG1、GOT1、GSTα、5’-NT和SDH的酶活相应增强。给药前和给药24小时后,每只大鼠采集~250 μL血样,并制备血浆样本。分别检测ARG1、GOT1、GSTα、5’-NT和SDH的酶活性。
肝毒性生物标志物和促炎细胞因子的关联增加
在肝细胞坏死早期,由于巨噬细胞上的toll样受体识别特定分子(DNA片段、DNA结合蛋白等),导致促炎细胞因子释放。5这些细胞因子又导致急性期蛋白释放,进一步影响肝细胞损伤。为了比较对乙酰氨基酚给药后,细胞因子释放动力学与肝毒性标志物浓度升高的关系,对相同时间点取样的两组血液蛋白进行检测。结果显示5种肝细胞毒性标志物与细胞因子MCP-1、GRO/KC/CINC-1和MIP1α的动力学变化一致(图3)。
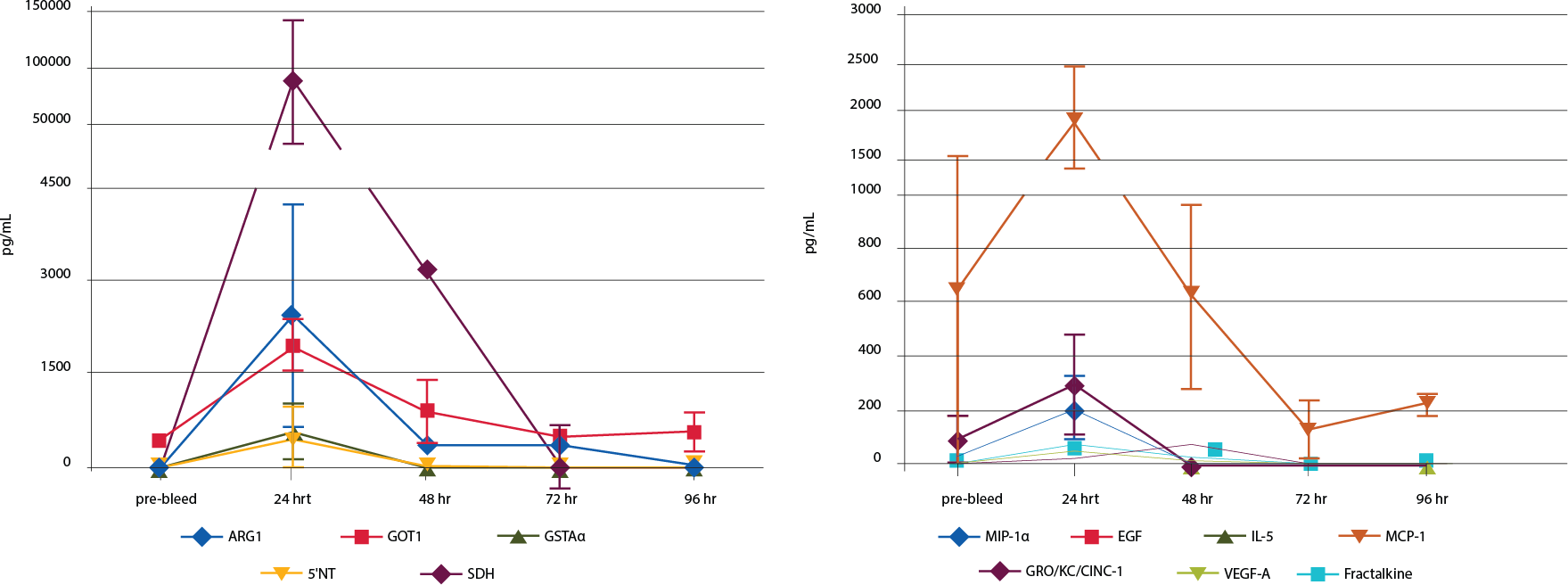
图 3.鼠对乙酰氨基酚损伤模型中肝毒性生物标志物和细胞因子的时程检测。(图左)肝毒性生物标志物:给药前与给药24、48、72和96小时后,每只大鼠采集~250 μL血样,并制备血浆样本。用MILLIPLEX®大鼠肝损伤Panel检测血液ARG1、GOT1、GSTα、5’-NT和SDH蛋白浓度。(图右)细胞因子:给药前与给药24、48、72和96小时后,每只大鼠采集~250 μL血样,并制备血浆样本。共检测27种特征性循环细胞因子,选择其中几种显示。
由于不同DILI临床前模型的影响组织和分子机制不同,改用硫代乙酰胺诱导大鼠DILI模型重复图3实验(图4和图5)。7用MILLIPLEX®大鼠细胞因子/趋化因子Panel盒检测27种特征性细胞因子,最后显示APAP模型和TAA模型具有不同的细胞因子表达模式。

图 4.大鼠硫代乙酰胺肝损伤模型中的ARG1、GOT1、GSTα、5’-NT和SDH血液蛋白浓度均升高。给药前和给药24小时后,每只大鼠采集~250 μL血样,并制备血浆样本。采用MILLIPLEX®大鼠肝损伤Panel定量分析血液蛋白浓度。

图 5.鼠硫代乙酰胺肝损伤模型中的瘦素(Leptin)、MIP-1α、IL-10、IL-18、MCP-1、IP-10、GRO、VEGF、Fractalkine和LIX均增加。给药前和给药24小时后,每只大鼠采集~250 μL血样,并制备血浆样本。采用MILLIPLEX®大鼠细胞因子/趋化因子Panel定量分析27种细胞因子。
图4和图5同图1一样显示所用Panel的标准曲线,通过未给药 (“CTRL”)和硫代乙酰胺给药(“TOX”)大鼠血浆中的生物标志物浓度对应平均荧光强度(MFI)绘制而成。注射硫代乙酰胺后,瘦素(Leptin)、MIP-1α、IL-10、IL-18、MCP-1、IP-10、GRO、VEGF、Fractalkine和LIX的血液蛋白浓度上调,与肝细胞毒性生物标志物变化一致。
结论
MILLIPLEX®大鼠肝损伤和细胞因子/趋化因子Panel通过定量免疫检测方法,同时准确地测量血循环中的肝毒性生物标志物和特征性细胞因子。两款检测Panel均具有稳健的灵敏度、特异性(无交叉反应)、准确度、精密度及宽广的线性动态范围。
对乙酰氨基酚和硫代乙酰胺是强效的肝毒性物质,可诱发大鼠的中心小叶肝细胞坏死。大多数肝损伤生物标志物都属于肝细胞酶,在肝细胞损伤时释放入血。急性肝损伤与强大而多变的免疫反应有关,循环细胞因子浓度变化也被推荐作为可用的生物标志物。采用两种大鼠肝损伤模型研究肝毒性生物标志物和循环细胞因子的动力学变化。药物暴露24小时后,观察到蛋白峰浓度上升。酶活性与蛋白浓度存在强关联性,在同一时间点也观察到大幅提升。
这些定量免疫检测试剂盒是可供研究人员在研究中监测肝毒性的强大方法。
材料
仅供研究使用,不可用于诊断。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?