核酸电泳方法 & 简介
简介
DNA琼脂糖凝胶电泳
RNA琼脂糖凝胶电泳
DNA聚丙烯酰胺凝胶电泳
参考文献
简介——什么是电泳?
电泳是根据基质上的净电荷、大小和构象对核酸(DNA 和 RNA)和蛋白质等大分子进行分离纯化的方法。由于磷酸基团的存在,核酸具有整体负电荷。因此,它们向阳极移动的速度完全取决于它们的大小。蛋白质含有整体的正电荷或负电荷;这使得蛋白质分子能够向一个称为等电点的 pH 移动,在该等电点分子没有净电荷。通过对蛋白质进行变性,并给予它们均匀的电荷,就可以根据大小将它们分开。大分子在由琼脂糖或聚丙烯酰胺组成的基质或凝胶内电泳。由这些聚合物制成的凝胶含有孔隙,当施加电压时,蛋白质和核酸可以通过这些孔隙。
DNA 琼脂糖凝胶电泳
琼脂糖是从海藻中提取的多糖,通常以0.5-2%的浓度用于DNA和RNA电泳。它可形成具有合适孔径的晶格,以便核酸能够移动到正极。
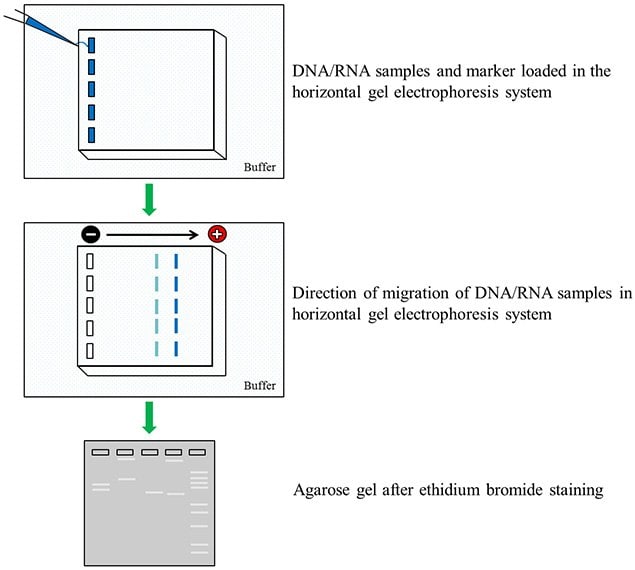
图 1.核酸琼脂糖凝胶电泳
实验方案:DNA 琼脂糖凝胶电泳
所需材料和试剂
- 电泳室,包含电源、灌胶板和点样梳
- Bionic™ 缓冲液 (B6185) 或下列其中一种电泳缓冲液:
1X TAE (65497) ,包含:
0.04 M Tris-醋酸盐 (pH 7.6)
0.001 M EDTA
或
1X TBE (93290),包含:
0.13 M Tris (pH 7.6)
45 mM硼酸
2.5 mM EDTA
- 上样缓冲液 (G7654, G2526) 或在 1X TAE 或 1X TBE 中使用以下材料制备:
50% 甘油
0.25% 溴酚蓝 (B5525)
0.25% 二甲苯腈蓝 FF (X4126)
- BlueView™ 核酸染色剂(T9060和T8935 )、SYBR® Green核酸染色剂 (S9430) 或溴化乙锭:在蒸馏水中制备0.5μg/ mL。
- 透射仪
预制琼脂糖凝胶
Sigma-Aldrich 可提供加入溴化乙锭的8孔、20孔和24孔预制琼脂糖凝胶。如果使用预制凝胶,则继续“凝胶通电”步骤。
也可通过以下步骤自行灌制琼脂糖凝胶。
琼脂糖溶液制备
- 量取适量琼脂糖粉,加到烧杯或烧瓶中的 1X TAE 缓冲液中。
说明:琼脂糖量取决于所需凝胶的百分比。琼脂糖溶液的体积必须根据所用凝胶拖盘的大小来制备 - 在磁性加热板上加热溶解琼脂糖。也可在微波炉中加热,每分钟旋转一次,直到琼脂糖完全溶解。
- 当琼脂糖冷却至 50-60°C 时,向溶液中加入溴化乙锭(0.5µg/mL 最终浓度)。另一种方法是电泳后将凝胶浸入溴化乙锭溶液中。
重要提示: 溴化乙锭是一种致癌剂。处理溴化乙锭时务必佩戴手套和口罩。 - 琼脂糖冷却时,准备好凝胶托盘以进行灌胶,使琼脂糖溶液在凝固前不会流出。这可以通过使用托盘隔障、Flexicaster或用传统的实验室胶带密封来实现。将梳子置于凹槽中,并将托盘置于平坦的水平位置。
- 慢慢倒入琼脂糖溶液,使其均匀地分布在托盘上,确保没有气泡滞留在凝胶中。使凝胶在室温下固化。
- 取出梳子,用托盘将凝胶转移到电泳槽,加入1X电泳缓冲液,直到凝胶刚好被缓冲液覆盖。
DNA 样品制备
Sigma-Aldrich 提供 GenElute™ 试剂盒,用于从植物和真菌 (E5038)、哺乳动物细胞或组织 (G1N70, G1N10 和 G1N350)、以及血液 (NA2010 和 NA2020)中分离 DNA。
为保护分离的 DNA 不被降解,建议将 DNA 溶解在 TE 缓冲液中 (T9285)。
此外,DNAstable® 试剂盒 (93000-001-1EA, 93021-001-1EA, 53091-016-2ML 和 93121-017-1EA)可用于DNA运输或确保DNA在室温下的储存和稳定。
- 按标准方法从细胞或组织中分离 DNA。
- 用溴化乙锭染色时,在琼脂糖凝胶上检出所需的最低 DNA 浓度为 2 ng。
- 将核酸样品与 10X 上样缓冲液混合。一般情况下,3 μL 上样缓冲液就足够了,但少于 10 μL 的样品可使用更少的量。
运行凝胶
凝胶染色和观察
掺入溴化乙锭的凝胶:
- 电泳后,将凝胶转移至紫外透射仪,并获取凝胶图像。
- 样品将显示为亮带。
未掺入溴化乙锭的凝胶:
- 将电泳后的凝胶转移至SYBR® Green核酸染色剂(1:10,000 稀释,避光染色)或 0.5µg/ml 溴化乙锭染色溶液中 15-30 分钟。
- 如果使用 SYBR® Green 核酸染色剂,则可在染色后立即获取凝胶图像。
- 如果使用溴化乙锭,将凝胶置于蒸馏水中 10-30 分钟,确保凝胶完全浸入水中。
- 将凝胶转移至紫外透射仪并获取凝胶图像。
- 样品将显示为亮带。
琼脂糖凝胶荧光染色
Sigma-Aldrich可提供 Nancy-520 (01494),这是一种可用于替代溴化乙锭的荧光染色剂。它是一种更安全、更稳定、更环保的溴化乙锭替代品。Nancy-520 的激发波长为 520 nm,发射波长为 560 nm。
掺入Nancy-520 的凝胶:
- 灌胶时可将 Nancy-520 掺入琼脂糖中(10 μL 至 50 mL 琼脂糖)。
- 电泳后,获取凝胶的荧光图像。
未掺入 Nancy-520 的凝胶:
- 加入 10 μL Nancy-520 至 50 mL 1X TBE 缓冲液制备染色液。
- 电泳结束后,将凝胶浸入染色液中,并在摇床上避光保存 1小时。
- 用 1X TBE 缓冲液冲洗凝胶 10-30 秒。
- 拍摄凝胶的荧光图像。

图 2.水平电泳系统
RNA 琼脂糖凝胶电泳
琼脂糖凝胶电泳可以根据RNA的大小和完整性来评估RNA的质量。然而,由于广泛的分子内碱基配对干扰了琼脂糖凝胶上基于大小的迁移,RNA形成了各种二级结构。因此,RNA 分子必须使用甲酰胺和甲醛进行变性。
实验方案:RNA 琼脂糖凝胶电泳
所需材料和试剂
确保所有使用的设备都不含RNAses,所有使用的缓冲液都采用无RNAses的水配制。
- 电泳室,包含电源、灌胶板和点样梳
- 1X MOPS-EDTA-乙酸钠 (MESA)缓冲液 (M5755):
40 mM MOPS
10 mM 乙酸钠
1 mM EDTA (pH 8.3)
- RNA样品缓冲液(R1386 和 R4268)
62.5% (v/v) 去离子甲酰胺
1.14 M 甲醛
1.25X MESA缓冲液
200 µg/mL溴酚蓝 (B2225)
200 µg/ml 二甲苯腈蓝FF ( X4126 )
Sigma-Aldrich可提供含/不含溴化乙锭的RNA 样本缓冲液 (R1386)
- SYBR® Green核酸染色剂 (S9430) 或溴化乙锭:0.5μg/ mL 蒸馏水溶液
- 透射仪
预制琼脂糖凝胶
Sigma-Aldrich可提供 8 孔 RNA预制1.25% 琼脂糖凝胶 (P6222)。这种预制凝胶不含溴化乙锭。如果使用预制凝胶,则继续“凝胶通电”步骤。
也可通过以下步骤自行灌制琼脂糖凝胶。
琼脂糖溶液的制备
- 量取适量琼脂糖粉,加到烧杯或烧瓶中的 1X MESA 缓冲液中。
说明:琼脂糖量取决于所需凝胶的百分比。琼脂糖溶液的体积必须根据所用凝胶拖盘的大小来制备 - 在磁性加热板上加热溶解琼脂糖。也可在微波炉中加热,每分钟旋转一次,直到琼脂糖完全溶解。
- 当琼脂糖冷却至 50-60°C 时,向溶液中加入溴化乙锭(0.5µg/mL 最终浓度)。另一种方法是电泳后将凝胶浸入溴化乙锭溶液中。
重要提示: 溴化乙锭是一种致癌剂。处理溴化乙锭时务必佩戴手套和口罩。 - 琼脂糖冷却时,准备好凝胶托盘以进行灌胶,使琼脂糖溶液在凝固前不会流出。这可以通过使用托盘隔障、Flexicaster或用传统的实验室胶带密封来实现。将梳子置于凹槽中,并将托盘置于平坦的水平位置。
- 慢慢倒入琼脂糖溶液,使其均匀地分布在托盘上,确保没有气泡滞留在凝胶中。使凝胶在室温下固化。
取出梳子,用托盘将凝胶转移到电泳槽,加入1X电泳缓冲液,直到凝胶刚好被缓冲液覆盖。
RNA 样品的制备
- 哺乳动物细胞或组织(RTN70, RTN10 和 RTN350)可使用TRI Reagent® (T9424)或 GenElute™ 试剂盒从细胞或组织样品中分离 RNA
- 为了确定 RNA 的质量和浓度,分别在 260 nm 和 280 nm 处读取样品的吸光度。吸光度比值A260/A280为 1.8-2.1 表示 RNA的质量较好。为了通过琼脂糖电泳法进行有效检测,至少需要 5 μg 的 RNA。
- 将 1 体积的 RNA 样品与 2-5 体积的样品缓冲液混合。
- 将样品加热至 65°C 10 分钟,并立即在冰上冷却,以防止 RNA 分子复性。
运行凝胶
凝胶染色和观察
掺入溴化乙锭的凝胶:
- 电泳后,将凝胶转移至紫外透射仪,并获取凝胶图像。
- 样品将显示为亮带。
未掺入溴化乙锭的凝胶:
- 在无RNase的蒸馏水中轻轻洗涤凝胶 10 分钟以除去甲醛。
- 电泳后将凝胶转移至SYBR® Green 核酸染色剂 (1:10,000) 或 0.5µg/ml 溴化乙锭染色溶液中 15-30 分钟。
- 如果使用 SYBR® Green 核酸染色剂,则可在染色后立即获取凝胶图像。
- 如果使用溴化乙锭,将凝胶置于蒸馏水中 10-30 分钟,确保凝胶完全浸入水中。
- 将凝胶转移至紫外透射仪并获取凝胶图像。
- 样品将显示为亮带。
DNA 聚丙烯酰胺凝胶电泳
聚丙烯酰胺凝胶是由丙烯酰胺和双丙烯酰胺(N,N'-亚甲基双丙烯酰胺)反应形成高度交联的凝胶基质。丙烯酰胺凝胶可以分离长度相差仅 0.2% 的 DNA 片段。虽然蛋白质在聚丙烯酰胺上分离前必须经过SDS变性,但带负电荷的DNA分子不需要变性。与琼脂糖凝胶相比,聚丙烯酰胺凝胶可以容纳更大量的样品,并提供高分辨率的 DNA 片段。
尽管DNA的预制PAGE凝胶被广泛使用,但如果PAGE是实验室的常规程序,那么成本就很高。熟练的技术人员可以以预制凝胶的仅一小部分成本轻松制备 PAGE 凝胶。内部制备的 PAGE 凝胶可提供更好的分辨率,并有助于获得一致的结果。
实验方案:DNA 聚丙烯酰胺凝胶电泳
所需材料和试剂
包含电源、玻璃板、垫片和点样梳的垂直电泳室
- 30% 聚丙烯酰胺溶液(0.45 mM 滤膜过滤,4℃ 避光保存):
29 g 丙烯酰胺
1 g 双丙烯酰胺
100 mL 双蒸水
- 10% 过硫酸铵溶液
- TEMED
- 电泳缓冲液:
1X TBE 蒸馏水溶液:
89 mM Tris (pH 7.6)
89 mM硼酸
2 mM EDTA
- 5X 凝胶上样缓冲液:
80% 甘油 75%
溴酚蓝 (B5525) 0.25%
二甲苯腈蓝 (X4126) 0.25%
1M Tris (pH 7.4) 10 mM
5 M NaCl 10 mM
0.5 M EDTA 10 mM
10% SDS 0.1%
- 溴化乙锭 0.5µg/ml
- 透射仪
重要提示:丙烯酰胺和双丙烯酰胺在性质上具有神经毒性。所有步骤均应佩戴无粉手套进行。
操作流程
- 用去离子水和乙醇清洁凝胶浇注装置的玻璃板和垫片。
- 将玻璃板和垫片组装在稳定的表面上。
- 根据所需凝胶的百分比,使用以下体积制备凝胶溶液(制成体积为12 mL)。
* TEMED必须最后添加。
- 将凝胶溶液倒入组装了垫片的玻璃板中。立即插入点样梳,确保凝胶中或梳齿周围没有气泡。将凝胶在室温下放置约 30-60 分钟
聚合凝胶可用保鲜膜包裹并储存在 4°C 条件下,以备将来使用。
- 准备进行电泳时,将凝胶板安装在仪器上,用1X TBE缓冲液填充电泳室。建议在5v /cm下预运行约10分钟。
- 通过将 1 μL 样品与 5μl 5x 凝胶上样缓冲液混合来制备寡核苷酸样品。小心地将样品加入孔中,不得产生任何气泡。
- 大型凝胶可以约70 V电泳14-16 小时或 125-150 V电泳2-4 小时,或直到染料前沿接近凝胶底部。确保凝胶不会过热。也可让样品在冷室中进行更高电压的电泳。
- 用刮刀撬开玻璃板,把上面的玻璃板分开。用 0.5μG/mL 溴化乙锭溶液给凝胶染色,同时仍然将其附着在下玻璃板上 5-10 分钟。
- 将玻璃板上的凝胶浸泡在蒸馏水中 10-30 分钟,去除多余的染色并降低背景染色。
- 用保鲜膜包裹凝胶和凝胶板,倒转置于紫外透射仪上并获取凝胶图像。
- 样品将显示为亮带。
- 所需条带可用精细的手术刀切割并适当处理,以便回收 DNA。
如果在寡核苷酸中加入35S或33P核苷酸,请遵循以下步骤:
- 将凝胶在 10% 乙酸中浸泡 15 分钟。
- 将凝胶拍干,用保鲜膜包裹。
- 在 80°C 真空干燥器中干燥凝胶 20 分钟或更长时间。
- 去除保鲜膜,在暗室将凝胶暴露于 X 光胶片中。

图 3.垂直电泳系统
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?