寡核苷酸退火实验方案
本实验方案用于两条序列互补的单链寡核苷酸的退火反应(图1)。加热后冷却有助于杂交反应的进行。
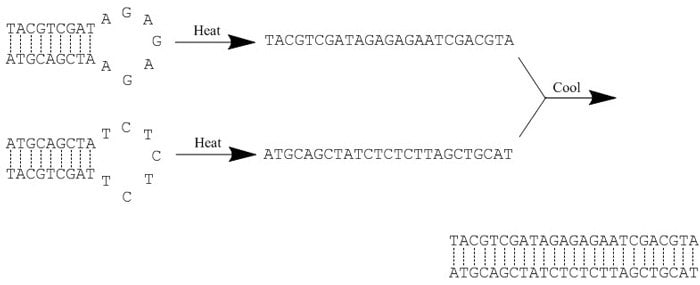
图 1.退火反应示例图。加热“打破”了所有的氢键,从而破坏了每个寡核苷酸内的全部二级结构。随后,缓慢的冷却促进了杂交反应,最终在互补的序列间形成新的氢键。
DNA / RNA退火设备和耗材
DNA / RNA退火方法
该退火反应分为两个主要的步骤:1)溶解,2)使用恒温槽或者热循环仪退火。
Oligo 溶解
尽管每种寡核苷酸都是已知量的,我们仍然建议使用分光光度计进行验证, 这可以保证加入反应的每种寡核苷酸是等量的。
- 将每种寡核苷酸溶解在一定体积的退火缓冲液(请参阅补充说明)中使得浓度相同。
- 每种寡核苷酸溶液的浓度都需要是双链寡核苷酸目标浓度的2倍。
示例
双链寡核苷酸目标浓度为50 µM。
- 寡核苷酸1:标注OD值为10.55(312.6 µg, 49.9 nmol),使用分光光度计验证OD值。
- 寡核苷酸2:标注OD值为9.04(279.7 µg, 45.9 nmol),使用分光光度计验证OD值。
- 由于每种寡核苷酸原液的浓度都需要是双链寡核苷酸目标浓度的2倍,因此,每种原液的浓度需要达到100 µM。
- 对于寡核苷酸1,需添加 49.9 x 10 = 499 µL的退火缓冲液以得到100 µM的原液。
- 对于寡核苷酸2,需添加 45.9 x 10 = 459 µL的退火缓冲液以得到100 µM的原液。
*以上为配制100 µM溶液的简单计算方法,仅作为示例。如需了解更多关于不同寡核苷酸浓度的计算,请参阅“处理指南和稳定性”。
Oligo退火
恒温槽
- 在离心管内混合等体积的等摩尔浓度的寡核苷酸。
- 将离心管于95 °C培养5 min。
- 将离心管置于室温缓慢冷却(应<60 min)。
热循环仪
相对于恒温槽,热循环仪的稳定性更好。
- 在PCR管内混合等体积的等摩尔浓度的寡核苷酸。
- 使用下面的温度设定程序:
- 加热至95 °C并保持2 min。
- 在45 min内冷却至25 °C 。
- 冷却至4 °C 以短期保存。
- 加热至95 °C并保持2 min。
- 对PCR管短时离心并弃去上层水分。
在恒温槽或者热循环仪操作后,得到的双链寡核苷酸可以用于后续操作或者用于保存。更多关于保存核苷酸的信息,请参阅“处理指南和稳定性”。
DNA退火缓冲液配方
所有缓冲液均采用Milli-Q®纯水配制。
退火缓冲液组分 (1X)
- 10 mM Tris, pH 7.5 - 8.0
- 50 mM NaCl
- 1 mM EDTA
连接酶缓冲液组分 (1X)
此缓冲液通常用于T4 DNA连接酶。
- 50 mM Tris-HCl, pH 7.5
- 10 mM MgCl2
- 1 mM ATP
- 10 mM DTT
激酶缓冲液组分 (1X)
此缓冲液通常用于T4多核苷酸激酶。
- 70 mM Tris-HCl, pH 7.6
- 10 mM MgCl2
- 5 mM DTT
登录以继续。
如要继续阅读,请登录或创建帐户。
暂无帐户?