聚糖的质谱
简介
配备有高分辨率和质量准确性的现代质谱(MS)设备的发展已使其可用于分析聚糖以进行图谱和结构研究。与HPLC法不同,单个MS图谱通常需要显著更大量(~10-20倍)的聚糖。基质辅助激光解吸/电离飞行时间(MALDI-TOF)质谱是应用最广泛的质谱技术。通过MALDI MS所获得的信息是质量重量,而由于单糖的质量是能够高精度测量的,因此其可用于分析存在于纯寡糖中的假定单糖结构。MALDI MS可与使用外切糖苷酶的聚糖测序结合使用,以进行聚糖的结构和连锁分析。
MALDI MS可使用不同的方法和基质来分析中性和酸性聚糖(含有唾液酸的聚糖)。中性聚糖可使用2,5-二羟基苯甲酸(2,5-DHB)作为正离子模式的基质以合理的效率发生电离。由于唾液酸或羧基的丢失不同,酸性聚糖通常在DHB基质上得到的MALDI光谱较差,从而会出现多个峰。因此,可使用稍后将描述的替代基质以负离子模式分析这些聚糖。
中性聚糖的质谱
与肽不同,中性聚糖展现出了低电离效率,因此[M+H]+离子是不够丰富的。然而,这些聚糖可被检测为能有效电离的碱金属加合物。在大多数过程中,[M+Na]+是主要的离子,并伴有较弱的[M+K]+离子。其他加合物,如[M+Li]+可通过向基质中加入适当的无机盐而生成。在基质溶剂中加入NaCl可使聚糖主要以[M+Na]+形式电离,且没有或几乎没有[M+K]+离子形成。
通常,2,5‑DHB基质足够用于大多数应用。然而,也有报道在某些情况下使用“Super DHB”基质可使灵敏度提高2到3倍,因为它允许“更软”的解吸并减少亚稳离子的形成。“Super DHB”由2,5‑DHB和2‑羟基-5‑甲氧基苯甲酸的混合物(90:10,wt %)组成。
将卵清蛋白(0.5 mg)与7个单位的蛋白质组学级PNGase F酶(货号P7367)在37 °C下孵育3小时,并通过超滤进行聚糖回收。三分之一的该材料会在真空离心下干燥,然后通过MALDI-TOF MS进行分析。图1展示了卵清蛋白的N-连接聚糖图谱,并对十二个信号进行了识别分配(表1)。
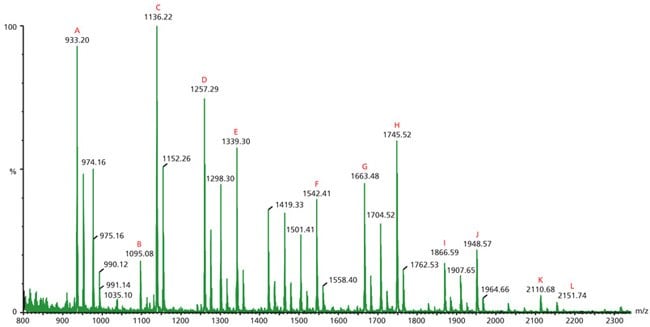
图 1.通过PNGase F处理而释放的卵清蛋白中性N-连接聚糖的正离子MALDI MS,并以2,5-DHB作为基质进行了记录。字母(A-L)表面已识别的峰结构,如表1所示。
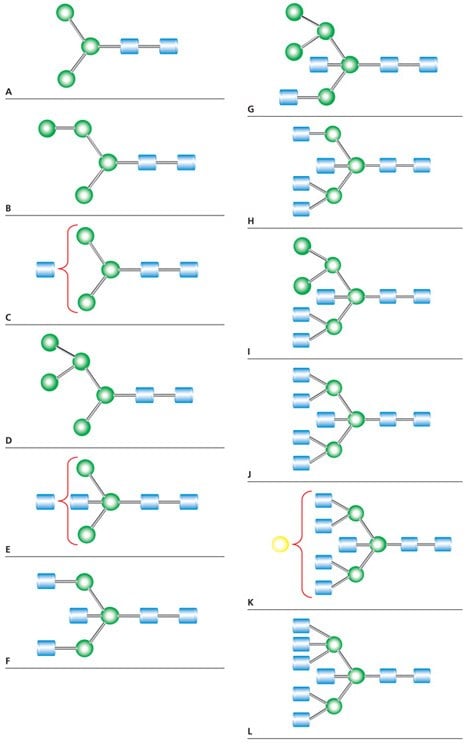
表1对应于图1中MALDI-MS峰的N-连接聚糖结构。
聚糖分析的通用质谱过程
以下这种通常被称为干滴法的方法,是基于原始的MALDI实验并仍然是质谱界最常用的方法。
- 将3 μL适当的基质溶液(10 mg/mL的DHB或Super DHB)转移到0.5 mL Eppendorf®管中。
- 向装有基质的管中加入1μL 10 pmol/μL的标准品聚糖溶液或未知的样品溶液;涡旋混合。
- 将一份(约1.5 μL)这种混合物分配到MALDI目标板上。
- 让其在室温下变干。
注意:可在此阶段采集质谱。但是,以下步骤据报道可通过形成均匀的晶体膜来改善信号,其可降低在目标上搜索“最佳点”的需求。 - 将1 μL乙醇加至干涸的斑点上并使基质与分析物的混合物在目标板上重结晶。
- 让斑点变干。目标现在即可采集质谱了。
图2展示了从三种聚糖标准品Man-3聚糖(A)、Man-8聚糖(B)和NA4聚糖(C)所获得的代表性MALDI-TOF MS踪迹。
![利用DHB作为基质在正离子反射模式下获得的(<strong>A</strong>)Man-3聚糖、(<strong>B</strong>)Man-8聚糖和(<strong>C</strong>)NA4聚糖的MALDI-TOF质谱。这些聚糖都是作为分子离子[M+Na]+的钠加合物而被检测到的。 MALDI-TOF MS踪迹](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/protocols/protein-biology/protein-mass-spectrometry/maldi-tof-ms-traces/maldi-tof-ms-traces.jpg)
图 2.利用DHB作为基质在正离子反射模式下获得的(A)Man-3聚糖、(B)Man-8聚糖和(C)NA4聚糖的MALDI-TOF质谱。这些聚糖都是作为分子离子[M+Na]+的钠加合物而被检测到的。
酸性聚糖的质谱
DHB是聚糖MALDI MS分析中最广泛使用的基质。然而,该基质并不是酸性聚糖(如唾液酸化的N-连接糖)的理想选择,因为与中性聚糖相比,其检测限较差且在羧基和/或唾液酸基团丢失的情况下可能会发生断裂。此外,以正离子模式分析的唾液酸化聚糖生成了可产生多个峰的阳离子加合物的混合物。一种提高灵敏度的方法是衍生化聚糖,但这可能会影响聚糖的绝对定量。另一种方法是选择一种能够解决分析过程中的断裂以及提高的检测限问题的基质。
两种广泛用于分析酸性聚糖的基质是6-氮杂-2-硫代胸腺嘧啶和2,4,6-三羟基苯乙酮(THAP)。前者的灵敏度显著高于DHB基质,但在负离子线性模式下仍会引起一些断裂。通过THAP,分析的检出限可达到10 fmol的水平,且线性模式下断裂迹象非常微弱甚至没有。以下所概述的基于该基质的样品制备条件对于获得最高的灵敏度至关重要。
为了防止唾液酸的酸催化内酯化,可在将聚糖加到MALDI目标板上并风干前,将其溶解在0.2 M的氢氧化铵溶液中。用水将斑点再水化,并加上THAP和柠檬酸铵的混合物(在1 mL 乙腈与20 mM柠檬酸铵1:1的混合物中的1 mg THAP)。样品斑点的真空干燥可用于防止大晶体的形成。随后让样品从空气中吸收水分,以促进小晶体的形成。
图3是单唾液酸化的N-连接聚糖A1在负离子线性模式下获得的代表性MALDI-TOF MS图谱。
![使用THAP作为基质在负离子线性模式下并作为[M-H]-离子进行检测而获得的A1聚糖的MALDI-TOF质谱 A1聚糖的MALDI-TOF质谱](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/protocols/protein-biology/protein-mass-spectrometry/maldi-tof-mass-spectrum-of-a1-glycan/maldi-tof-mass-spectrum-of-a1-glycan.jpg)
图 3.使用THAP作为基质在负离子线性模式下并作为[M-H]-离子进行检测而获得的A1聚糖的MALDI-TOF质谱
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?