癌症研究人员采用 3D 细胞培养的5个原因:近期文献综述
总结
简介
3D中生长的细胞改变增殖和细胞形态
3D中生长的细胞揭示了更现实的药物反应
3D生长细胞捕获表型异质性
3D中生长的细胞改变基因表达和细胞行为
3D中生长的细胞模拟肿瘤微环境
结论
参考文献
总结
许多癌症模型系统可用于调查疾病机制和筛选疗法。虽然所有的模型都提供了有关癌症生物学的重要信息,但目前的方法存在重大问题。在所有治疗类别中,大约 90% 的有发展前景的临床前药物未能有效地被用于人体治疗,从而浪费了大量的时间和金钱,并最终延迟了成功干预(van der Worp等,2010)。在最简单的观点中,二维 (2D) 组织培养模型不能体现现实的复杂性,而动物模型昂贵、耗时且经常不能反映人类肿瘤生物学(Aggarwal等,2009;Hait,2010 ;van der Worp等,2010)。这篇白皮书介绍了细胞生理学中的 5 种改变,这些改变提示了为什么在转移到昂贵和耗时的动物模型之前,癌细胞的三维 (3D) 培养是一种科学严谨的方法来生成新的候选药物。将3D文化添加到你的实验室中,可以加快发现速度,并在开发癌症模型用于临床前筛查和测试,以及新的治疗研究和开发时节省资金。
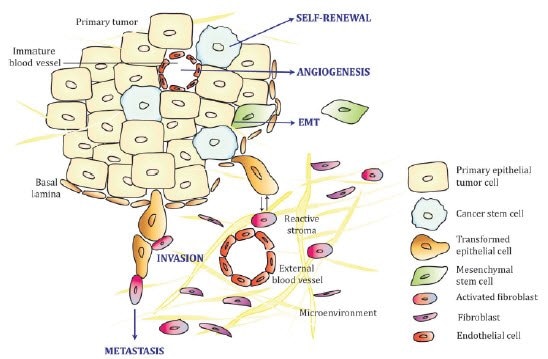
图 1.上皮肿瘤和周围环境——一个复杂的生物学模型。图片来自Kimlin等,2013
简介
临床前癌症药物研究是所有治疗领域中成功率最差的,仅有 5% 的候选化合物通过了 III 期临床安全性和有效性试验(Hutchinson和Kirk,2011)。研究人员设计了大量的模型系统来研究肿瘤的复杂成分(图 1)及其治疗,每种都有独特的优点和缺点。所有型号都有两个关键要求。首先是监控细胞数量和生存能力的能力,因为癌症的一个关键特征是由多种机制维持的不受控制的细胞增殖。其次是研究癌细胞向周围组织迁移和侵袭的能力,因为癌细胞转移不仅损伤周围组织,而且使治疗复杂化。复杂且理想但具有挑战性的模型特征包括血管生成刺激和免疫系统逃避,这两者都有助于长期肿瘤存活。最好的临床前模型将相对便宜,适合高通量筛选,最重要的是,尽可能地反映人类肿瘤生物学。
最简单的癌症模型是源自人和动物肿瘤的细胞系,其在培养基中作为扁平单层培养。在这种结构中,细胞粘附在人造塑料或玻璃基板上,仅在其外围与其他细胞接触。不存在氧气、营养物或废物梯度;环境在非生理上是均匀的。用细胞外基质 (extracellular matrix,ECM) 包被培养皿,可恢复较自然的基底黏附;然而,除非细胞被允许堆叠在一起,否则它们仍然被迫进入单层形态,这对所有细胞类型来说都不是自然的。在平皿中建立共培养可以增加自然的细胞间接触和通讯,但 2D 表面仍然抑制细胞形成多维结构的能力。在塑料表面的扁平层中生长的细胞根本不能反映体内发现的多细胞微环境。毫无疑问,在 2D 培养中生长的永生化肿瘤细胞系为癌症的发生机制提供了大量的知识,但 95% 的药物失败率 (Hutchinson and Kirk,2011) 证明它们是一个糟糕的药物开发模型。
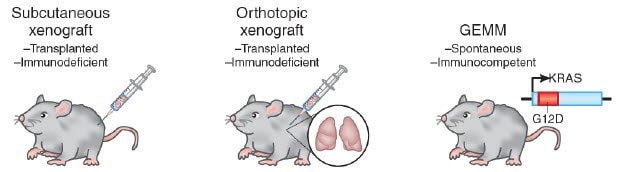
图 2.啮齿动物癌症模型。图片改编自 Francia and Kerbel,2010
动物模型被用作人类肿瘤生长的活体孵化器(通常是免疫缺陷的生物体),从而与整个生物体相互作用。癌症是在啮齿动物模型中通过手术植入肿瘤细胞或创造基因工程动物来建立的,这些动物响应基因表达的实验性改变而自发地发展出类似人类的肿瘤(图 2)。
乍一看,这似乎是模仿人类疾病的固有的理想系统。尽管广泛用于筛选,但这些昂贵的动物模型未能发展成为可转化为人类疾病改善结果的疗法(Aggarwal等,2009;Hait,2010;van der Worp等,2010)。此外,有许多形式的致命癌症目前缺乏合格的动物模型,包括脑、肾和皮肤(Steele和Lubet,2010)。动物模型失败的原因尚不完全清楚。确定原因最终会导致对疾病过程的更多理解,但是目前这些模型显然没有产生高投资回报率的治疗方法。
在进行临床试验之前,科学家们一直在开发 3D 组织培养模型,以弥合用于发现和筛选的体外实验与用于有效性和安全性评估的体内实验之间的差距。使用具有定制微环境的 3D 模型来解剖癌症生物学和建立治疗屏幕是合乎逻辑的,并且证明其优于2D和早期动物测试的系统的证据正在迅速出现。这篇白皮书的目的是简要回顾最近的 3D 细胞培养出版物,这些出版物举例说明了 3D 技术在理解癌症生物学方面的科学价值。
3D 中生长的细胞改变增殖和细胞形态
当癌细胞生长成扁平单层时,它们在整个表面以相对均匀的速度增殖。然而,在 3D 中生长相同的细胞诱导不同的增殖区域(图 3),细胞分裂在球体外部发生得更快(Lin和Chang,2008)。一般而言,这导致一些(但不是全部)被检测的癌细胞系的增殖速率轻度降低(Chitcholtan等,2013;Longati等,2013;Myungjin Lee等,2013;Zschenker等,2012)。建议的增殖速率变化机制包括整个球体的氧/营养/生长因子梯度 (Lin 和 Chang 2008),ECM 依赖的细胞内信号变化(Kim等,2011,Tibbitt and Anseth,2012)和基质细胞影响(McMillin等,2013)。
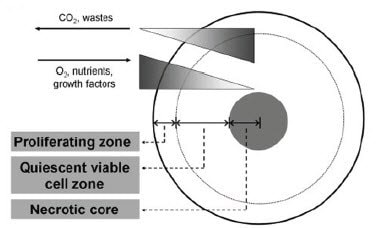
图 3.细胞在球状体中的生长导致由于氧、营养和废物梯度引起的不同区域的增殖。图来自 Lin 和 Chang,2008。
细胞在 2D 表面上的生长通过简单的几何图形产生相应的扁平细胞;只有一个表面可以粘附。迫使一侧粘附在基底上,而另一侧没有细胞接触的机会,会导致默认的顶端-基底极性和细胞形状的改变,最终改变细胞功能(Baker和Chen,2012)。仅仅在3D中生长肿瘤细胞系,甚至是具有缺省顶端-基底极性的卵巢上皮细胞(图4 ),都会诱导组织形态学,使人联想到它们来源的肿瘤类型(Myungjin Lee等,2013)。当相同的卵巢上皮细胞系在 2D 中生长时,没有这种组织学分化。封装在Matrigel™中的选定前列腺和乳腺癌细胞系的培养显示出球状或星状细胞形态,表明侵入行为的差异(Hama等,2010)。然而,子宫内膜癌和结肠癌细胞系的类似实验未能产生可预测侵袭行为的形态学(Chitcholtan等,2013;Luca等,2013)。Matrigel 中 3D 培养的可变反应突出了来自不同器官的恶性肿瘤的先天变异,以及微环境如何影响细胞产生临床相关的观察结果。因此,3D 培养可用于研究肿瘤形态,以及了解来自相似和不相似器官和组织肿瘤的细胞系之间的差异。
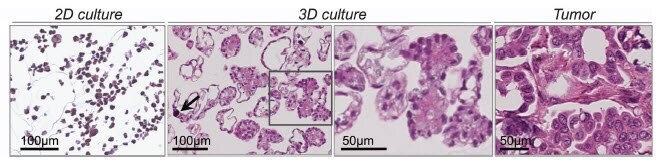
图 4.OAW42上皮性卵巢癌细胞生长在2D和3D中,后者与最右边显示的分化良好的(1级)浆液性卵巢肿瘤相似。3D 培养甚至包含沙粒体(箭头),这是一种在一些肿瘤中发现的钙化环状结构。图片改编自(Myungjin Lee等,2013)。
3D 中生长的细胞揭示了更现实的药物反应
与单层生长的相同细胞相比,生长成 3D 球体的细胞可以增加对化疗的抵抗力。增强抵抗力最直接的解释是,球体内部的细胞受到球体外部细胞的药物渗透保护(Perche和Torchilin,2012)。有人提出了另一种与上述差异增殖区有关的机制(Chitcholtan等,2013)。一些化疗药物(如顺铂)通过在增殖细胞中诱导 DNA 损伤起作用,其严重程度足以诱导细胞凋亡。封闭在球体内部的静止群体将受到保护而不受顺铂等药物的影响,然后一旦外部细胞死亡,就可以自由重新进入细胞周期。如果治疗过早停止,这些“受保护的”细胞可能能够重现一个缩小但没有完全杀死的肿瘤。耐药机制可能比仅仅不能完全穿透体内肿瘤并通过球体生物学在体外反映更加复杂。当白血病细胞系与骨髓间充质干细胞在 2D 或 3D 系统中共同培养时(图 5 ),与 2D 培养相比,3D 培养提供了对阿霉素的化学保护,尽管实验表明两种模型都允许药物完全渗透(Aljitawi等,2013)。
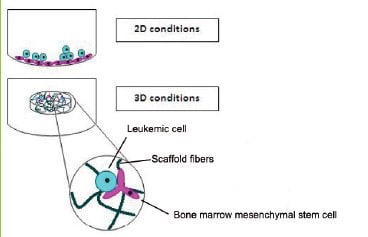
图 5.白血病3D培养物比2D培养物对阿霉素的耐药性更强,尽管两种模型的药物渗透率相同。图片来自(Aljitawi等,2013)。
此外,与 2D 培养相比,胰腺癌细胞系以及来自胰腺癌小鼠模型的新鲜分离的胰腺细胞表现出几种耐药基因和 microRNA 的表达增加,导致 3D 培养中的耐药性增加(Longati等,2013)。这些结果表明,3D 培养概括了在体内肿瘤中发现的几种耐药机制,提供了在进行动物模型和最终临床试验之前详细分析机制和在体外测试多药治疗方案的机会 。
3D 生长细胞捕获表型异质性
异质性发生在同一肿瘤内的细胞群中,以增殖速率、基因表达和分化的改变为标志,导致形态和功能的改变(Marjanovic等,2013)。各种各样的表型行为使得靶向药物杀死整个肿瘤具有挑战性,因为生理学可能存在很大差异。有两种理论可以解释这些差异。克隆选择理论假设表型和基因型异质性是由遗传不稳定性导致突变而带来的,也许在表观遗传学改变之后是由于个体肿瘤细胞之间的竞争而导致的选择(Kreso等,2013;Marusyk 和 Polyak,2013)。选择压力可能是由营养缺乏、肿瘤生长或药物治疗的压力造成的。由于肿瘤球体具有氧气和营养梯度,因此可以建立 3D 模型,该模型比连续传代的小鼠异种移植肿瘤更容易地测试这些理论。事实上,目前已经建立了卵巢上皮癌发生和发展的 3D 模型来研究这些确切类型的遗传变化(Lawrenson等,2011)。
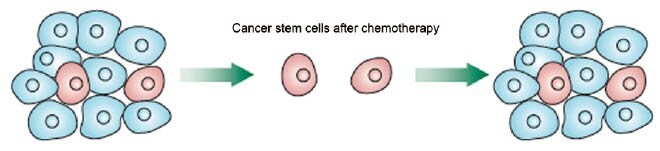
图 6.罕见的所谓癌症干细胞存活 (CSC) 传统的化疗治疗,并可以重演整个肿瘤,包括一个新的子集的CSC。图片改编自Vermeulen等,2012。
第二个有争议的理论认为,肿瘤干细胞 (CSC) 的存在要么是寻找肿瘤微环境中产生的小生境,要么是由小生境本身的信号产生的(Borovski等,2011)。体外球体或体内肿瘤的微小数目的细胞表现出“干细胞样”特征,包括增殖速度减慢、自身分化和可进行多向分化的未分化表型(Schiavoni等,2013)。CSCs 可以在药物治疗后重建肿瘤(图 6),这在 3D 球体模型和接受化疗的患者中都有描述 (Chitcholtan等,2012)。当比较作为 3D 球状体生长的实体肿瘤细胞系与单层时,可观察到“干性相关基因”的表达增加(Busse等,2013)。虽然这些类型的结果显然不能明确证明 CSC 的存在,但这些类型的结果说明了体外3D 微环境产生类似于体内群体的“干细胞样”群体的趋势,而该群体被认为是造成肿瘤耐药性的原因。对于艰难的治疗和因此致命的癌症,如胶质母细胞瘤,在体外描述和复制 CSC 起始和存活的微环境 可能是获得潜在治疗的最快途径(Filatova等,2013)。
3D 中生长的细胞改变基因表达和细胞行为
与生长为单层的完全相同的细胞相比,在 3D 培养中生长的细胞产生不同的基因表达模式(Myungjin Lee等,2013;Luca等,2013)。在3D或3D共培养模型中,与ECM(图 7)和基质细胞的不同细胞外相互作用改变了细胞内信号转导,最终在2D与3D模型中激活了一组独特的转录因子(Bellis等,2012)。由于转录因子最终负责基因表达,细胞接触的改变直接导致基因表达的改变。如上所述,这些基因表达的改变驱动了形态学、增殖率和耐药性的改变,所有这些改变都促进了更具代表性的癌症组织的形成。反过来,肿瘤基因表达的这些变化可以通过改变 ECM 或信号因子的分泌来改变细胞间对培养物内其他细胞的反馈(Longati等,2013)。
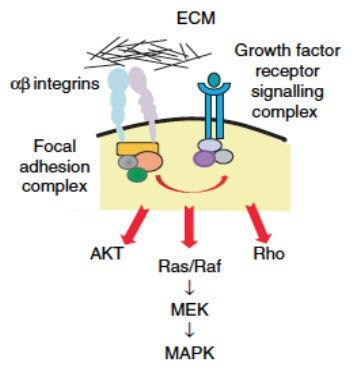
图 7.关于ECM如何控制细胞内信号的一个假设是通过跨膜整合素蛋白的不同亚型的结合。然后整合素与各种细胞内衔接蛋白相互作用形成粘着复合物,调节生长因子受体下游的信号通路。图片改编自Kim等,2011。
这些基因变化的高潮影响细胞行为,如细胞迁移和分化,这些都与肿瘤进展的严重程度密不可分。典型的细胞迁移已经在 Boyden 小室系统或单层划痕试验中受到质疑,但是由于结果更可能与临床相关,因此相关人员正在共同努力在更复杂的 3D 环境中对这些试验进行重新定位(Burgstaller等,2012)。在 3D 中生长的正常体细胞和肿瘤细胞之间的细胞行为差异相当明显,以至于仅仅通过在 3D 中生长就有可能区分正常细胞和转化细胞(Fassert等,2013)。当正常人支气管上皮细胞在 2D 培养中生长时,它们增殖直至形成融合单层,但在 3D Matrigel 培养中,它们分化成特征性的含腔腺体结构,称为腺泡(Wu等,2011)。当几种不同的上皮肺癌细胞系在 3D 基质胶培养物中生长时,它们每个细胞数量形成更多的球状体,并不是分化并形成管腔,而是简单地增大。3D文化在理解癌症方面的潜力,甚至有朝一日在快速诊断屏幕方面的潜力也刚刚开始被认识到。
3D 中生长的细胞模拟肿瘤微环境
正如以上所有例子所说明的,在 3D 培养中生长的细胞更接近于在活肿瘤内生长的细胞。创建体外3D癌症模型最令人兴奋的一个方面是能够通过实验操纵肿瘤微环境的每个组件,试图理解癌症作为疾病状态的驱动因素。以 Mina Bissell 的开创性工作为例,他的实验室是第一个认识到当正常乳腺上皮细胞生长成单层时,它们通过几代以指数形式分裂的实验室。
然而,当乳腺上皮细胞在 3D Matrigel 培养中生长时,它们通过减少增殖并分化成几乎正常大小的乳腺腺泡结构来响应微环境信号(图 8)(Petersen等,1992;Tibbitt 和 Anseth,2012 年)。来源于乳腺癌的细胞不能对 Matrigel 微环境中的信号作出反应,继续分裂但是并不能形成管腔。进一步说,这意味着癌症不仅是肿瘤细胞的疾病,也是周围微环境的疾病。这对于已经建立并作为单层繁殖的细胞系具有重要意义。毫无疑问,细胞作为单层的长期传代可能导致对外部信号的应答能力丧失。这可以部分解释为什么癌细胞系在回到 3D 环境后,原有的癌症表型恢复不完全。事实上,从结肠癌原发患者样本中建立稳定的球体培养物需要维持一些细胞接触作为簇来防止死亡 (Kondo等,2011)。从肿瘤中建立单层可能会选择能够在高度不自然的环境中生存的罕见细胞,也许不是建模肿瘤的最佳材料。
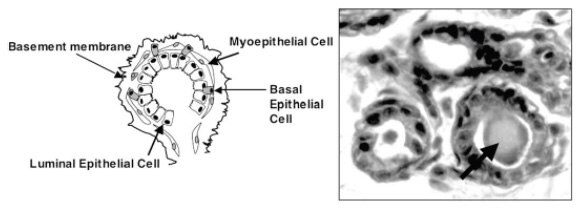
图 8.左侧为乳腺腺泡,右侧为形态相似的3D培养衍生的MCF-10A腺泡。体外衍生的腺泡的管腔内部甚至含有分泌物质(箭头)。图像改编自Debnath等,2003。
如果不提及癌症相关成纤维细胞 (CAF) 在疾病进展中的作用,那么对肿瘤微环境的讨论就不会完整。这些细胞的起源目前还不是很清楚,但它们似乎在肿瘤微环境的建立和维持中起着至关重要的作用(Allen and Jones 2011;Cirri 和 Chiarugi,2011)。有证据表明,肿瘤内癌细胞发出的信号激活周围的基质细胞成为 CAF(图 9)。正常的成纤维细胞分泌 ECM,其包含排列有基质隔室的支架。CAF 分泌的 ECM 具有改变的蛋白质谱,与正常成纤维细胞相比,它可以对肿瘤细胞的行为产生深远的影响。此外,CAF 分泌多种生长因子,刺激肿瘤细胞增殖。鉴于越来越多的证据表明 CAF 影响肿瘤的增殖和转移,它们正在成为组合癌症药物治疗的关键靶点。将 CAF 包括在 3D 癌症模型中可以增加对其在肿瘤进展中的作用的理解,并发现在单层模型中仍然未被发现的新的潜在疗法。
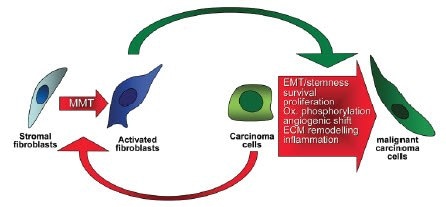
图 9.癌细胞通过称为 MMT(间充质 - 间充质转化)的过程启动从成纤维细胞到 CAF 的进程。然后 CAF 提供多种生长因子信号并分泌 ECM,促进癌细胞的进展、存活和迁移。图片改编自 Cirri 和 Chiarugi,2011。
结论
在体外重述肿瘤要求肿瘤的所有成分都存在,以重现典型的细胞形态和功能、ECM、增殖的肿瘤细胞、CSC 和基质细胞。在Perfecta3D® 悬滴板中创建的3D培养物的巨大灵活性允许对所有这些变量进行实验操作(图 10)。这些成分中的每一个都会影响其他成分的生物学和行为学,并最终形成功能性肿瘤模型。当细胞从肿瘤中移除并在组织培养塑料上单层生长时,这些相互作用的丧失改变了它们的行为,并导致理解生物学或建立适当疗法的不合标准的模型。这反映在大量的药物杀死癌性单层,但未能证明临床相关性。
仔细控制以上讨论的所有变量会增加癌症模型更可能准确代表肿瘤微环境的可能性。3D 模型甚至可以比人类癌症动物异种移植物更加逼真和可控,在这些异种移植物中,肿瘤细胞经常被移植到那些虽然便于肿瘤观察但却不能反映原始肿瘤微环境的部位。
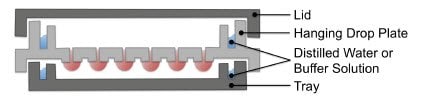
图 10.Perfecta3D悬滴板的示意图。培养物可以用单一细胞类型或共培养物、多种起始细胞数以及添加或不添加外源ECM来建立。
即使移植部位是原位的,啮齿动物和人体生理学之间的物种差异也可能导致无法建立错综复杂的肿瘤微环境。尽管有这些限制,但在人类临床试验之前,在动物模型中总是需要评估疗效和毒性的某些方面。然而,早期利用 3D 培养优势的临床前研究可以极大地提高对癌症生物学的理解,消除较差的候选药物,并且最有希望地揭示在 2D 筛查中可能遗漏的更多生理相关的新靶点。建立 3D 模型系统可以通过更早地生成更显著的真实结果来节省时间和金钱。
欲了解更多关于建立3D培养的信息,请访问我们的3D细胞培养知识中心www.3DBiomatrix.com。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?