3D生物打印生物墨水选择指南
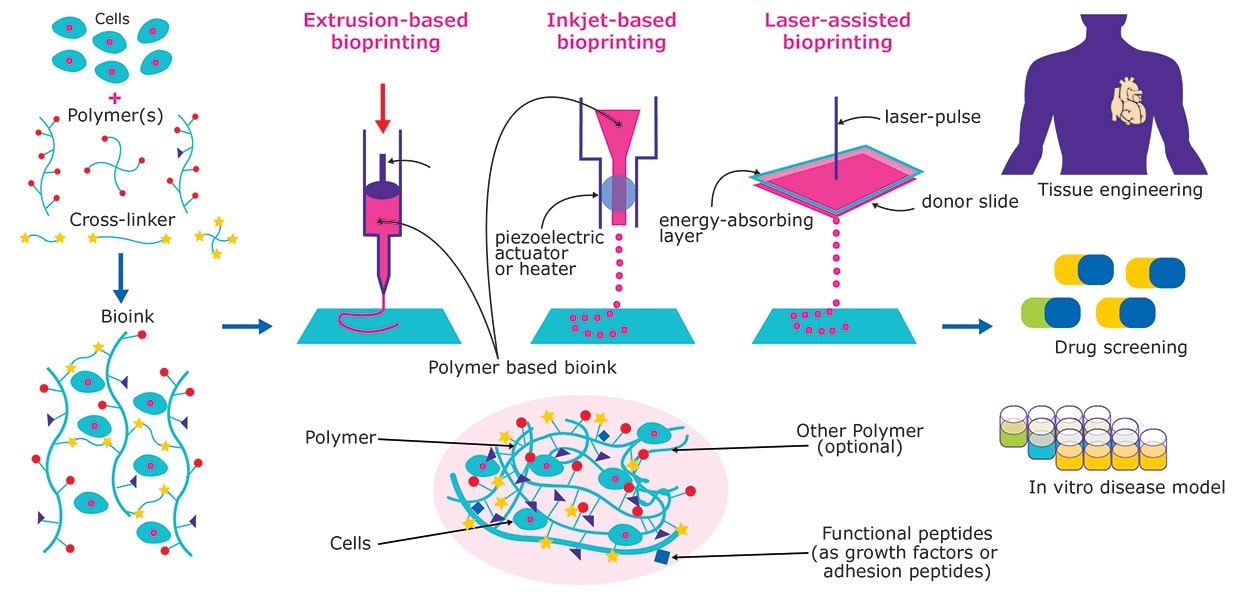
图 1.组织和器官3D生物打印将培养细胞和各种生物相容性材料相结合,可创造出生物墨水。随后可利用生物墨水3D生物打印形成功能组织结构,从而应用于药物筛选、疾病建模和体外移植。
何为生物墨水?
生物墨水包含活细胞和模拟细胞外基质环境的生物材料,可在打印后为细胞粘着、增殖和分化提供支持。与传统3D打印材料相比,生物墨水必须具有以下特征:
- 打印温度不超过生理温度
- 交联或凝胶条件温和
- 生物活性成分无毒,打印后能够被细胞修饰
用于挤出式生物打印的生物墨水:细胞封装水凝胶
细胞封装水凝胶用于3D生物打印,通过形成多细胞生物打印构件创建活体组织结构。相对于其他方法和材料,细胞封装可精确控制支架内的细胞粘附以及细胞和生物分子的空间分布。1通过以指定模式组合多种细胞类型和生长因子,可生成高度复杂的细胞。3除了生物相容性之外,用于细胞封装的生物打印材料还必须兼具高含水量和孔隙率,支持封装细胞接收营养物质并清除废物。1水凝胶是遇水膨胀的多孔网络结构,因而是细胞封装 、组织工程和3D生物打印应用的理想材料。用于3D、生物打印的水凝胶还必须具有可调节的基材刚度,支持打印后进行网络重塑,以便细胞扩散、迁移、增殖和相互作用。9虽然生物墨水使用了多种材料,但最通用的材料包括明胶甲基丙烯酰醇 (GelMA)、胶原蛋白、聚乙二醇 (PEG)、Pluronic®、藻酸盐和脱细胞细胞外基质 (ECM) 材料(表 1)。
推荐生物墨水材料:甲基丙烯酰胺(GelMA)
甲基丙烯酰胺(GelMA)用于形成用于组织工程和 3D 打印的交联水凝胶。GelMA基生物墨水具有出色的细胞相容性、可调基材刚度、改良印刷性能,且可在紫外线或可见光下快速交联(取决于光引发剂的特性)11。GelMA已用于内皮细胞形态形成、心肌细胞、表皮组织、可注射组织构建物、骨分化和软骨再生。甲基丙烯酰胺明胶还用于药物递送所用的微球和水凝胶。
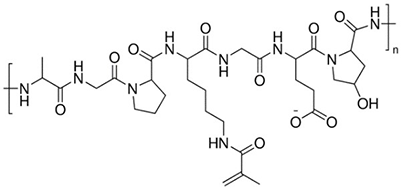
图 2.甲基丙烯酰胺明胶
脱细胞材料:结构支架和聚合物
除生物墨水之外,脱细胞材料还用于 3D 生物打印结构。2脱细胞材料通常为组织构建体提供结构支撑——与生物墨水一起使用时,可形成功能性生物打印组织。脱细胞材料是多孔结构,兼具天然细胞外基质 (ECM)4 的机械和生化特性4。孔隙使这些结构构建体中的细胞可以进行迁移、组织生长、血管形成并维持细胞活力。6此外,脱细胞材料还必须具有支持细胞粘附、增殖和分化的表面化学性质。5流行的脱细胞材料包括:胶原蛋白、纤维蛋白 、壳聚糖、纳米纤维素、聚乳酸 (PLA)、聚己内酯 (PCL)、碱式磷酸钙(HA) 和 β-磷酸三钙 (β-TCP)(表 1)。
应该选用哪一种3D生物打印方法?
根据所选墨水类型(生物墨水或脱细胞材料)和最终组织构建的复杂程度,可选用不同的 3D 打印方法(图 1)。常用打印方法的优缺点参见下表(表2)。
除了墨水类型之外,生物打印方法还取决于打印结构的最终应用(表 3)。
结论
3D生物打印可在指定的3D微环境中空间可控地铺板细胞。通过细胞和各种生物相容性材料混合可制成生物墨水,随后可将此墨水打印成特定形状,形成类组织的3D结构。我们融合了自身在材料科学和细胞生物学方面的专业知识,提供各种简化3D生物打印工作流程的解决方案。
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?