3D多能干细胞:简化的培养和实际分化
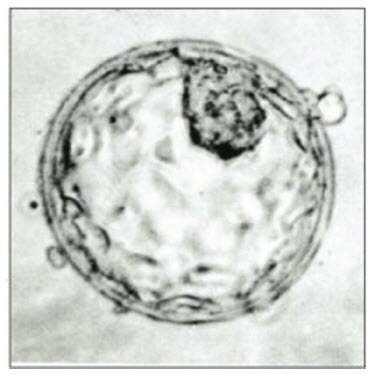
图 1.3D多能干细胞
简介
该白皮书阐述了三维(3D)细胞培养在生成多能干细胞(PSC)衍生的胚胎发育和分化模型中的重要性。它包括了对胚状体(EB)的一般概述,以及对生成胚状体的各种方法之间的比较。也有关于使用畸胎瘤试验对比EB来验证新衍生的PSC品系的多能性的讨论。最后,对阐述如何使用3D培养来最大化分化的一些近期文献进行了简要的描述。
生成胚状体
胚状体(EB)是一种与胚胎相似的PSC的3D聚集体,这意味着它们包含来自全部三个胚层(外胚层、内胚层和中胚层)的细胞。EB分化的初始阶段与植入后胚胎的早期分化非常相似1。在EB中分化的第一种细胞类型是原始内胚层的外层,其反过来又分泌了基底膜。
所分泌的细胞外基质围绕着相当于胚胎上胚层的原始外胚层细胞的内部。凋亡发生在未与基底膜接触的原始外胚层细胞中,并会导致一种囊性结构的形成。在胚胎中,胚外信号传导中心会在原条的上胚层中形成一个精确的位置,在这里开始了原肠胚形成过程,从而导致了中胚层和内胚层的形成。但是,EB缺乏胚外信号中心,因此,与胚胎相比,源自原始外胚层的中胚层和内胚层分化被认为是混乱且无序的。已有两个小组提出EB内的组织比以前认为的要多;当在适当的时间向EB发出正确的信号时,其组织可以得到显著的改善,从而使其与原肠胚形成等正常胚胎学过程非常接近2,3。这些特性使得EB成为了一种极佳的模型系统,可用于研究胚胎发育中的仅有可获取时间,尤其是在使用人类来源的细胞时4,5。
存在有多种不同的方法可以生成EB,图2列举了其中的一部分。所有这些方法的最重要特征是抑制PSC粘附在表面上,从而促进了E-钙粘着蛋白依赖性的相互粘附。
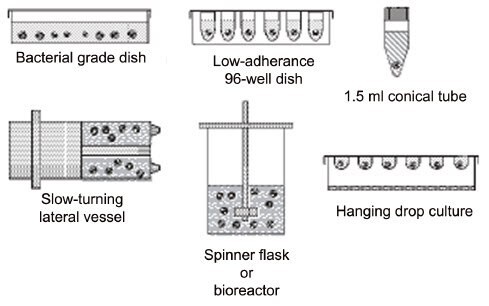
图 2.大量用于生成胚状体方法中的一部分。6
悬浮培养物,如细菌级培养皿(静态)、旋转瓶和缓慢转向的容器,易于设置和维护,但它们会导致不同大小的EB聚集成各种不同的形状(图3)。EB大小的增加会导致质量转运率的下降7。此外,众所周知EB大小和形状的改变都会改变分化模式8。再者,一旦原始内胚层开始分泌细胞外基质,EB便会随机开始粘附,甚至是在细菌培养皿的疏水表面上,导致粘附和浮动EB之间的谱系特性发生显著变化。旋转瓶和缓慢转向的容器可减少聚集并防止粘附在此前提到的表面上,但这必须与剪切力造成的细胞损伤进行平衡9。受力聚集培养,如圆底低粘附性板、离心管和改造的微孔皿(图2中未展示),可通过每孔中的细胞数而对EB大小进行精确的控制。
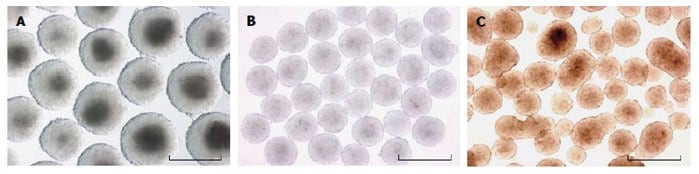
图 3.来自缓慢转向的容器(A)、悬滴培养(B)和细菌级培养皿中静态悬浮培养(C)的EB图像。请注意悬滴培养的EB在大小和形态上最为均一。图片摘自9。比例尺 = 500 μM
在微孔和管中进行受力聚集的一个缺点在于通过与刚性的人造塑料屏障接触来人为地决定和限制了EB的形状10。很难将EB从小孔和管中取出而不损伤其结构。图2中最具优势的方法是悬滴培养。接种的细胞数控制着悬滴EB的大小,并且任何人造塑料基材也不会对EB的形状进行限制,或与EB的表面发生接触。在过去,建立这些培养非常费力且困难,因为它们是在后续必须被倒置以悬挂液滴的板盖上形成的。为了对这些EB进行补给,研究人员必须将其转移到另一个组织培养容器中,通常是细菌级或低粘附性的培养皿。
Perfecta3D®悬滴板已极大改善了EB生成以及后续培养的过程。将一滴细胞悬液移液至每个孔的顶部,而板的几何形状会使细胞和培养基穿过孔并形成一个稳定的悬滴。位于每个孔顶部的进孔可进行培养基更换以及外源性细胞外基质、生长因子、小分子的添加,或者也可以加入其他细胞以建立共培养。这些选项都意味着极大的灵活性以及对EB分化的强有力控制。能够轻松地对培养基进行补给意味着它们能够维持在悬滴的形式显著更长的时间,从而避免了聚集或粘附在皿底。

图 4.Perfecta3D悬滴板
如需更多信息关于3D细胞培养并购买Perfecta3D®悬滴板,请访问:http://3dbiomatrix.com
验证多能性
新衍生出的PSC品系必须经过评估以确认是否具有真正的多能性。传统上,人类PSC品系都是在体外通过多能性基因的表达、表观遗传学分子以及EB形成试验,以及在体内通过畸胎瘤试验而进行验证的(图5)。通过小鼠PSC品系而建立的更为严格的多能性检测、四倍体互补11,12或被注射进宿主的胚泡中13,14,都因为伦理原因而不能用于人类PSC品系。一些科学家强烈认为畸胎瘤试验是用于人类PSC的最佳测定方法,并对于宣布新的品系多能性绝对必要。但是,畸胎瘤试验中存在着大量的变量,而建立一种可将来自不同新衍生PSC品系之间的结果进行更多比较的更统一的方法引起了人们强烈的兴趣15。
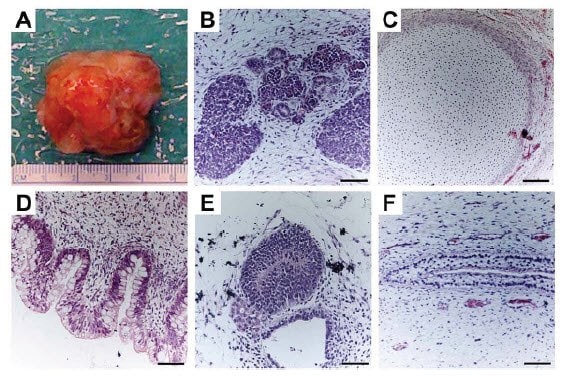
图 5.衍生自肾被膜下PSC注射的完整畸胎瘤(A)。包含中胚层(B、C)、内胚层(D)和外胚层(E、F)的畸胎瘤试验切片的苏木精和伊红染色图像。图片来自16。比例尺 = 100 μM.
由于诱导多能干细胞(iPSC)品系的生成速度要比胚胎干细胞系高得多,而畸胎瘤试验又被认为非常重要,因此该试验变得越来越繁琐、昂贵且耗时,且需要大量的实验动物 。因此,在决定是否必须使用畸胎瘤试验来证明多能性或一系列体外检测是否足够时,需要对几个重要的因素进行考虑。
在许多情况下,可生成一致大小和细胞数的标准化体外EB形成,结合可量化的谱系分析,是畸胎瘤试验一种有效的替代方法(图6)17。例如,由于iPSC的生物学和功能仍在被仔细地研究中,许多实验室都在生成新的品系以寻求建议人类疾病模型。此时便几乎不需要确定用作疾病模型的实验室细胞系的致癌性,因此花时间和金钱进行畸胎瘤试验就会被认为是在浪费时间和资源18。而至于iPSC是否能够生成更好模型的争论则已超出了本白皮书的范畴,并也将会是一个持续争论的主题19-21。此外,如果对特定细胞类型或组织的胚胎发育已经有了充分的了解,则可使用定向3D分化(在下一节中讨论)来评估新的PSC品系参与“正常”发育模型的能力,而这是一种畸胎瘤试验或自发性EB分化都未证明的品质22。
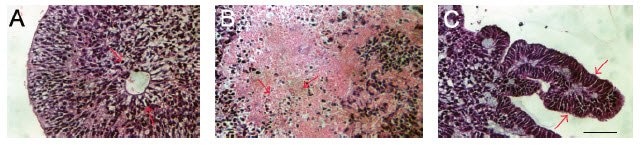
图 6.用苏木精和伊红染色的EB切片解释了向外胚层(A)、中胚层(B)和内胚层(C)的分化。17
最大化分化
某些细胞类型和组织始终需要3D培养而使其来自PSC的分化最大化。胚胎发育不是在单层中发生的,有无数示例说明来自一个胚层的细胞外信号是如何影响相邻胚层特性的。例如,心脏特性是发生在暴露于来自覆盖前内胚层的信号的中胚层细胞中的23。实际上,与2D培养相比,3D培养改善了来自人类PSC的心脏分化,而这可能是由于更多的生理信号传递、PSC衍生的心脏支持细胞的存在以及心肌整体更自然的3D结构的共同作用结果24,25。在胚胎发育过程中,表面外胚层的区域会先增厚,然后再形成一部分感觉器官,例如眼睛(视基板)和耳朵(耳基板)。这些区域的分化也需要那些就是无法在2D培养中生成的多层结构。对于胚胎分化的复杂模式并不存在限制,而这种模式是可以通过3D培养在体外更好地进行复制的。实际上,在一些令人震惊的例子中也有感觉基板自我模式分化的情况,从精确引发的EB分化为内耳毛细胞(图7)和视网膜色素上皮细胞26-28。
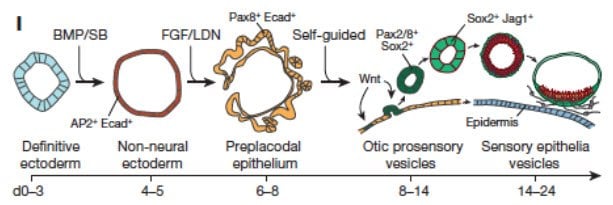
图 7.图形简化说明了PSC的3D分化为耳基板以及随后的感觉上皮。28
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?