细胞培养污染问题排查
细胞培养污染:概述
虽然细胞培养污染通常会让人联想到细胞中的细菌和混浊的培养基,但培养瓶中的不速之客可以有多种形式。病毒和化学污染物也会对培养物的健康造成严重影响,确保细胞系不受交叉污染对结果的可重复性至关重要。根据 FDA、ATCC 和其他机构的研究,估计目前所有细胞培养物中仅支原体就污染了 5 - 30%。在一项研究中,普通细胞系的病毒污染发生率超过 25%5,而且非细胞病理病毒比支原体更有可能逃避检测,因为培养物的健康状况可能无法提供其存在的线索。
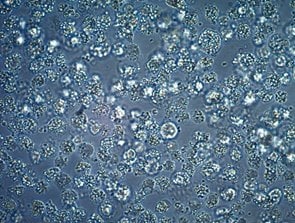
图 1.细胞污染
控制特定污染物的关键有时与检测它的难易程度有关。细菌、真菌和酵母污染物通常肉眼可见,并可能迅速杀死培养物中的细胞,但微妙的形态可能使支原体等重要的微生物入侵者更难识别。相比之下,传统的光学显微镜根本无法检测到病毒,因此病毒的发现往往是在观察到不明原因的脱落或其他细胞健康状况不佳甚至细胞死亡的迹象时。
近年来,生物学界面临的一个最重要的问题是研究细胞系受到污染甚至完全被误认。有关这一重要话题的更多信息,单击此处了解细胞系交叉污染的原因和普遍程度,以及如何评估细胞系身份的完整性。
支原体是一种不具有细胞壁的细菌,因此不会受到通过抑制细胞壁形成来限制细菌生长的抗生素的影响。支原体形态灵活,细胞大小在 0.15 到 0.3 微米之间,这意味着它们可以逃脱通常使用 0.22 微米孔过滤器的标准细胞培养过滤方法。与大多数其他细菌污染物不同,支原体不会被随便检查到,而且由于其形态和明显的小尺寸,很难通过光学显微镜检测到。支原体在培养液中的滴度可达 108 个/毫升,而不会导致培养基浑浊。它们通常不会杀死被其感染的哺乳动物细胞,但会通过改变细胞代谢、导致染色体畸变、减缓细胞生长速度和干扰细胞附着等方式对培养物产生重大影响。简而言之,它们可能会极大地影响大多数使用受影响细胞系进行的实验结果。
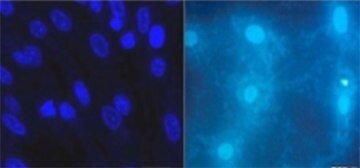
图 2.常见的 DNA 检测剂(如 DAPI 或 Hoechst)可利用荧光显微镜显示受污染培养物中支原体的存在(右图)。
实验室中支原体污染的来源多种多样,这给我们带来了挑战。由于某些支原体存在于人体皮肤上,除了通过受污染的补充剂(如胎牛血清)引入外,它们还可能通过不良的无菌技术引入。处理支原体时必须使用孔径为 0.1 µm 或更小的滤膜来过滤培养基和缓冲液,因为孔径为 0.22 或 0.45 µm 的标准培养基过滤装置无法排除这些小生物。
预防、检测和消除支原体污染
支原体一旦污染培养物,就会迅速扩散到实验室的其他区域。严格遵守 良好的实验室操作 是关键,为成功控制支原体污染,强烈建议进行支原体常规检测。最常用的三种检测方法包括 支原体培养, DNA 染色法 和 基于 PCR 的检测。 我们为 支原体检测和消除。即使您不怀疑实验室中存在支原体这种污染物,也必须建立对培养物进行支原体筛查的常规方法。
Preventing microbial contamination: are antibiotics the answer? 组织培养中的一种方法是常规使用抗生素,无论是单独使用还是与抗真菌剂混合使用。正如医生处方中的治疗性抗生素一样,持续或不适当地使用抗生素会导致耐药菌株的产生,这些菌株很难根除,而且可能需要使用对细胞培养物有毒性的新一代抗生素。最近的研究还对抗生素存在时培养细胞中基因表达发生改变的可能性提出了更多的担忧。 |
病毒污染
病毒是最难检测的细胞培养污染物之一。病毒是培养过程中最难检测的细胞培养污染物之一,需要采用显微镜方法,这对大多数研究实验室来说都是不切实际的。它们可能来自患者或宿主动物细胞源,一些具有生物技术意义的细胞系已被证实含有内源性逆转录病毒。病毒体积小,很难从培养基、血清和其他生物源溶液中清除。然而,由于大多数病毒受宿主甚至组织的限制,这可能会限制它们跨物种或跨组织感染的能力。尽管病毒在细胞培养物中的常见程度可能超过许多研究人员的认识,但如果病毒不会对细胞产生细胞病理或其他不利影响,它们可能会也可能不会对细胞培养造成重大干扰。
除了可能对培养细胞造成影响外,使用受病毒感染的细胞培养物的一个主要问题是它们对实验室人员的健康构成潜在危害。 在处理来自人类或其他灵长类动物的组织或细胞时,应始终采取特别的安全预防措施,以避免细胞培养物可能将病毒感染(HIV、乙型肝炎、Epstein-Barr、猿疱疹 B 病毒等)传染给实验室人员。 有关处理潜在危险组织、培养物或病毒的程序,应咨询机构环境安全官员。有关实验室人员使用细胞培养物进行风险评估的更多信息,click here
减少细胞培养物病毒污染的最佳做法:
*限制提取细胞的生物来源(供应商、动物)的数量。
*从进行病毒检测并提供无病毒细胞系认证的储存库中提取细胞。
化学污染
细胞培养过程中的任何非生物污染物通常都被归类为 "化学 "污染物。这些污染物可能来自培养基或缓冲液中使用的试剂或水,也可能来自设备和用品。
例如,自由基、金属离子、消毒剂/洗涤剂残留物,甚至是在上游细菌污染物消失后仍然存在的内毒素。
防止化学污染的提示:
*始终使用实验室级水 用于配制缓冲液和溶液以及重新悬浮冻干试剂。
*任何可重复使用的实验器皿都必须彻底冲洗并风干--高压灭菌对洗涤剂残留物没有影响。
*只从提供内毒素检测认证的供应商处购买培养基、补充剂和血清(FBS、FCS)。
General Tips and Techniques for Preventing and Eliminating Contamination
Working Within the Biological Safety Cabinet
在生物安全柜中工作时,请记住气流是帮助维持无菌环境的关键。前后通风口应始终保持畅通,以实现有效的空气流通。
在进行任何实际操作之前,柜内都应备有所需的所有材料,以尽量减少操作员袖子和手上污染物转移的可能性。所有进入柜内的物品必须先用 70% (v/v) 无菌酒精喷洒,并用 无绒湿巾 擦拭,以防止灰尘和微粒进入柜内。在打开任何顶盖或容器之前,确保已建立良好的气流,以便让气流清除工作区内可能已进入的微粒。

图 3.在安全柜中工作
移液器和气溶胶的预防
血清学移液管,容量为 1-100 mL--是细胞培养不可或缺的工具。这些移液管必须单独包装,以确保无菌。
- 使用自动移液管助吸器,每个移液管助吸器仅限在一个柜子中使用。 为避免污染,应定期拆卸和消毒移液管助吸器部件。确保移液管助吸器过滤器库存充足并定期更换。
- 尽可能使用带塞移液管(顶部用棉花塞住),尤其是在转移培养基时。
- 避免完全接触血清移液管,方法是解开部分包装,将一端与移液管助吸器连接,然后取下纸套。
- 为避免产生污染性气溶胶,不要在培养基或移液管中产生气泡。
消毒。
为培养废物、工作表面和设备的消毒/去污而设计的方法不仅要最大限度地降低污染风险,而且要确保实验人员的安全。使用高浓度消毒剂时,一定要穿戴适当的个人防护设备 (PPE),如手套和护目镜。所选手套应能防止所处理的物质。制造商提供的图表有助于确定最适合特定任务的手套。主要消毒剂可分为几组,其相对优点可归纳如下:
次氯酸钠或漂白剂
- 良好的通用消毒剂
- 对病毒有效
- 对金属有腐蚀性--不得用于离心机等金属表面
- 易被有机物灭活,因此应经常保持新鲜
- 使用商用漂白剂在废液中制成 10%(v/v)的溶液或用于表面消毒
酒精(如乙醇、异丙醇等)
- 有效浓度:乙醇浓度为 70%,异丙醇浓度为 60-70%
- 对细菌有效。乙醇对大多数病毒有效,但对无包膜病毒无效
- 异丙醇对病毒无效
- 醛类有刺激性,应限制使用
应避免使用酚类消毒剂,因为欧盟杀菌剂产品指令审查计划不支持酚类消毒剂。
如何对健康细胞进行常规监测
。监测细胞培养是日常细胞培养的重要组成部分。本教程将解释监测细胞的基本知识,包括健康培养物的外观、细胞汇合度和细胞培养生长的不同阶段。本视频还将展示细菌和支原体污染的常见指标。
相关产品
参考资料
如要继续阅读,请登录或创建帐户。
暂无帐户?