荧光纳米金刚石颗粒:性质和应用
简介
纳米金刚石 (ND) 颗粒越来越多地被用作生物医学中的诊断、成像和治疗剂,1,以及用于量子信息处理中的密码学和量子计算,纳米磁测量法中的单自旋传感器等。2,3这些应用大多基于与金刚石点缺陷相关的独特光学和磁性特性。由于宽禁带的存在,NS 通常含有原子缺陷或杂质,其中一些具有高发光性,使其可用作荧光、阴极发光或光声成像剂。1 ND具有高度的生物相容性,以及固有较低的细胞毒性和基因毒性。1
荧光纳米金刚石 (FND) 光学特性
氮是金刚石中最常见的杂质,以孤立取代氮原子或两个最近邻取代氮原子的形式存在于晶格中,此外还有许多含氮缺陷。氮原子捕获的空位根据金刚石中N态的类型形成不同的色心。导致金刚石呈红色/近红外荧光的氮空位 (N-V) 缺陷和具有亮绿色光致发光性的氮空位氮 (N-V-N) 色心(或 H3 中心)是受到最多关注的光学活性缺陷(图 1)。1-3 N-V中心是由一个替位式氮原子和相邻的空位在金刚石中形成的缺陷,而N-V-N中心是由氮-空位-氮络合物组成的(图 2)。用高能粒子辐照 ND 可以产生空位。随后的高温退火可导致空位扩散,并与氮原子形成色心。
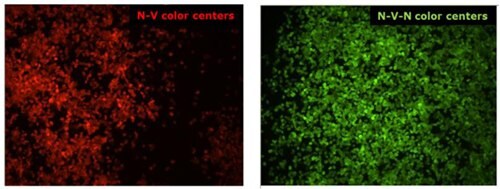
图 1.金刚石的荧光基于存在于金刚石晶格中的色心:氮空位中心 (N-V)发出红色荧光(左),N-V-N(或 H3 中心)发出绿光(右)。
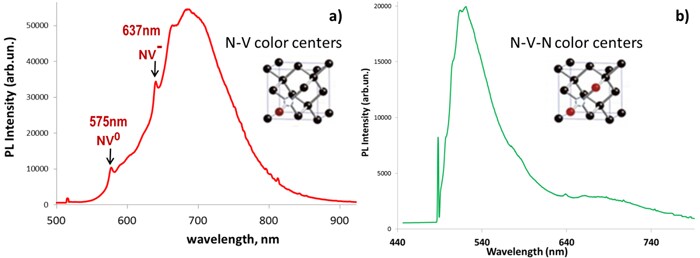
图 2.含有 N-V 中心 (a) 和 N-V-N 中心 (b) 的 100 nm ND 颗粒的光致发光发射光谱以1mg/mL的浓度分散在DI水中。激发波长分别为532nm和442nm。在488nm (b)处的峰值对应金刚石的拉曼位移。
N-V 中心的光学特性非常适合生物成像应用,光学激发波长为 490-560 nm,红色 \ 近红外发射波长为 (637-800 nm)(图 2a),与大多数自发荧光细胞成分差距较大。由于光在周围组织中具有更大穿透性,波长发射通常发生在低吸收的光谱窗内,对生物标记应用较有吸引力。对于带负电荷的缺陷 (N-V-),N-V 中心的光谱在 638 nm 处呈现零声子线 (ZPL),对于中性状态,在 575 nm 处呈现 ZPL(图 2a)。含有 NV 中心的 ND 的发光强度取决于颗粒中 N-V 中心的数量。例如,当使用全内反射荧光显微镜以相同条件并排测量时,100 nm ND 的 PL 亮度可能比Atto 532染料的亮度高一个数量级以上。当被蓝光激发时,H3 中心将发出最大约 530 nm 的绿色荧光(图 2b)。N-V 和 N-V-N 中心的一个显著特点是,即使在连续高能激发条件下,它们也不会发生光漂白或闪烁4,该前所未有的光稳定性使其优于常规发色团。
ND粒子中带负电荷的NV中心也已成为一种重要的量子传感系统。2,3由于 N-V- 中心的自旋态可以利用光学检测磁共振 (ODMR) 结合磁共振协议进行光学检测,且自旋态对于周围的磁场很敏感,因此含有单个 N-V- 中心的 ND 颗粒可用作适用于环境条件的超灵敏磁力计。除磁场外,N-V-中心对电场、温度和应变也表现出高敏感性。2,3
纳米金刚石表面化学
由于色心是嵌入到钻石基质中的,因此其荧光特性不受表面修饰的影响。1 虽然大块金刚石的表面被认为具有化学惰性,但 ND 通常含有许多含氧表面官能团(即-COOH、-OH、羰基、酯等),这些官能团是在使用强氧化剂纯化过程中产生的,或者是通过还原反应产生的(例如,使用氢化铝锂,LiAlH4)。5 ND也可通过用氢气蚀刻sp2碳而进行纯化。简便的表面官能化已通过化学、光化学、机械化学、酶促、等离子体和激光辅助方法完成。5 使用强化学处理或极端温度(即,用于灭菌的高压灭菌或用于储存的液氮)使得ND适合于医疗用途而不会降低核心的晶体结构(sp3 键合)。由于多种方法可实现表面官能化,ND可通过静电和共价相互作用而轻松地掺入其他可用于结合生物实体的基质中,如蛋白质、酶、激素、抗原、DNA或药物。6例如,脂质层中荧光ND的包裹可将颗粒在细胞质中的扩散提高一个数量级以上。7ND的表面适合于采用各种有机官能团进行衍生化,以用于随后与生物活性分子相连,使其非常适合于诊断和治疗应用。FND在不同细胞检测中的高度靶标特异性已被证实用于与链霉亲和素共价偶联的FND,其是与生物素标记的目标抗体相连的。8 为避免非特异性标记,建议使用牛血清白蛋白 (BSA) 作为稳定剂,使包覆BSA的金刚石纳米颗粒在磷酸缓冲盐水中具有较高的抗絮凝能力。9
应用
2005 年,FND首次被报道用于体外生物标记,10 证明含有N-V中心的FND可被细胞自发内化且毒性很低。这些金刚石的荧光亮度和稳定性使其可适用于细胞内的单粒子示踪。4 来自金刚石的稳定荧光使得长期的光学示踪和纳米级传感成为可能。通过对 N-V 中心荧光的时间门控检测 11 ,利用 ND 荧光相比细胞和组织自发荧光寿命(约3 ns)长得多的长寿特性(长达约20 ns),也可以改善细胞内 ND 的成像对比度。
FND的完美光稳定性通过受激发射损耗显微术 (STED) 实现了超分辨率成像。9 高分辨率的三维成像可以很容易地实时获取。 使用 STED 显微镜,以约 40 nm 的亚衍射分辨率在细胞中可区分出单个 FND 颗粒 (约30 nm)。9
多光子激发成像是一种强大的工具,它可以使活体组织成像具有更长的穿透深度。 它在焦点处激发荧光团,从而可减少细胞自发荧光。 此外,显微镜可提高成像对比度并降低对细胞的光损伤。 使用飞秒红外激光可检测细胞中的单个 FND 颗粒 (约40 nm) 。7
N-V-中心的自旋特性,即光学检测磁共振技术,可用于改善 FND 在体外 和 体内 的成像对比度,并能克服内源性分子引起的自发荧光问题。12,13 在体内宽视野荧光成像中,交替的微波辐射仅调节了N-V-中心的荧光强度,而背景荧光则保持恒定。图像处理可有效去除背景自发荧光信号,并显著改善图像的对比度。12 在另一种方法中,调节的磁场被用于实现位于前哨淋巴结中的ND的N-V-中心的无背景宽视野成像。14 图像的对比度被提升了近两个数量级。ND 中的某些色心具有阴极发光,并可在长时间电子束照射下保持稳定,从而为基于相关光和电子显微镜 (CLEM) 的生物成像技术提供了有价值的标记物。利用 CLEM 显微镜15可获得活体 HeLa 细胞中绿色和红色 FND 的彩色成像,显示了活体生物系统中具有良好空间分辨率的结构细节。这表明它们可用于提高临床诊断的敏感性。
综上所述,含色心ND 具有明亮荧光,且没有光漂白和闪烁现象,结合其生物相容性和良好的生物功能化特性,使 ND 成为分子成像和细胞标记的理想生物探针。ND 中某些类型色心的自旋和光致发光特性的独特组合为发现基于 ND 色心的生物成像和传感的新方法开辟了新的光明前景。
材料
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?