用于生物学应用的银纳米材料
银纳米材料具有独特的物理、化学以及光学性质,目前正在用于各种的生物应用。作为广谱的抗菌剂,银的功用重新受到重视,已开发了数百种包含银纳米粒子的产品来防止细菌在表面的生长。此外,银纳米粒子具有与其尺寸和形状相关的光学颜色。银纳米粒子与特定入射光波长的强耦合可用于开发超高亮度的报告分子、高效热吸收器和可放大局部电磁场强度的纳米级“天线”。我们总结了如何精确地设计银纳米粒子的尺寸和形状使其能够实现广泛的生物应用。
银纳米材料表面化学,形态学和光学性质
在银纳米材料合成期间,可以调整反应条件以产生具有各种形态的胶体银纳米粒子,包括单分散纳米球、三角棱镜、纳米片、立方体、线和纳米棒。为了其生物应用,必须小心控制银纳米粒子的表面化学性质、形态和光学性质,以获得在目标环境中期望的功能。
表面化学
在许多生物学应用中,需要调整不同缓冲液或介质中的胶体稳定性,或者通过表面相互作用来改变颗粒结合或摄取。可以改变颗粒的表面化学性质(即结合强度、官能团以及封端剂的尺寸)以达到对颗粒行为的额外控制。在水性介质中,许多纳米粒子通过在粒子表面添加带电粒种而达到静电稳定。电荷的类型和密度可以通过测量胶体的电动电势来确定。通常来说,由于表面结合了分子如柠檬酸盐,银纳米颗粒的电动电势一般为负值。通过将纳米粒子暴露于更紧密配位的配体(通常含有巯基或胺官能团)之中,新的封端剂可以结合到纳米粒子表面并改变其化学功能和电动电势。 用短链甲氧基末端的聚乙二醇(mPEG)分子替代柠檬酸盐离子可得到接近中性的电动电势,而用支链聚乙烯亚胺(BPEI)覆盖的粒子可产生具有高的正电动电势的胺密集表面。
形态学和光学性质
银和其它贵金属纳米粒子显示了与光的强烈的相互作用,因为金属表面的电子被特定波长的光激发时会发生集体振荡。这种振荡被称为表面等离子体共振(SPR),它导致银纳米粒子的吸收和散射强度比同等大小的非等离子体纳米粒子高得多。银纳米粒子的吸收和散射性质可通过控制粒子大小、形状以及靠近粒子表面局部折射率来调节。
球状银纳米粒子的光学性质高度依赖于纳米粒子的直径和均匀性,可通过仔细调整制造条件来生产尺寸可控的颗粒,变异系数(直径/平均直径的标准偏差)小于15% (图1A)。图1B中显示的是相同质量浓度(0.02mg / mL)下,10种不同尺寸的银纳米粒子的消光光谱。较小的纳米球主要吸收400nm峰附近的光,而较大的纳米球散射增加,在较长波长处具有更宽的谱峰和峰强度。
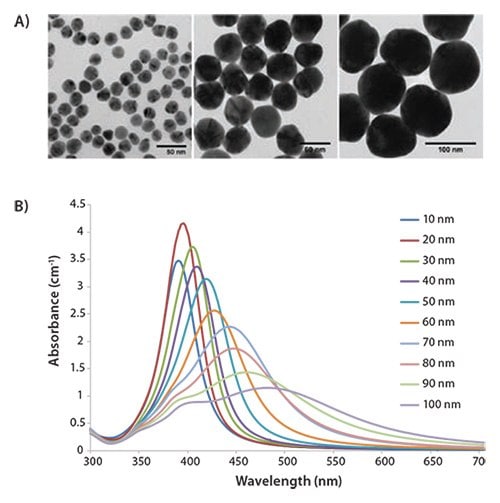
图 1.A)均匀的20nm、60nm和100nm直径的银纳米粒子的透射电子显微照片(TEM)。 B)质量浓度为0.02mg / mL,直径范围为10-100nm的银纳米粒子的消光(散射和吸收的总和)光谱。
银纳米片是表面等离子体共振(SPR)的薄片形纳米粒子(图2A),其在光谱的可见光和近红外区具有非常大的吸收和散射横截面。通过精确控制平板直径和厚度,纳米片的光学共振可以调整到特定波长(550 nm-950 nm,图2B和2C)的峰值。纳米片可应用于表面增强拉曼散射(SERS),太阳能光伏,分子检测和基于光热的治疗。
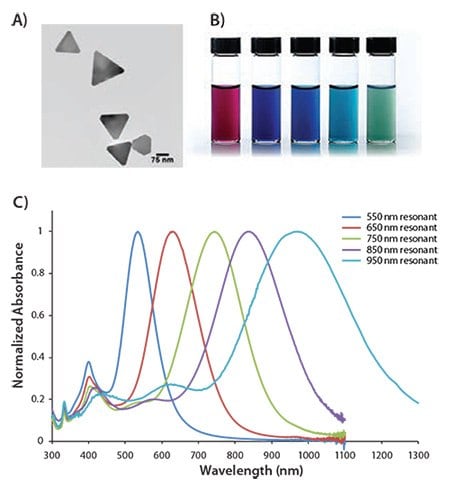
图 2.A)银纳米片的透射电子显微镜(TEM)图像。B)在光谱的可见光和近红外部分,纳米片具有调整等离子体共振的能力,其分散体也呈现出反映该能力的颜色(C)
表面增强光谱
银纳米粒子在生物中的其他应用基于其表面和表面附近的增强电磁场的利用。在等离子体共振波长处,银纳米颗粒充当纳米天线,增加了局部电磁场的强度。
从增强的电磁场中受益的一种光谱技术是拉曼光谱,其中分子可以通过其独特的振动模式来识别。尽管来自于分子的光子的固有拉曼散射很弱,并且需要长时间测量来获得拉曼光谱,但来自于等离子金属纳米粒子表面附近的分子的表面增强拉曼散射(SERS)提供了大大增强的拉曼信号。 SERS效应可以将结合分子的拉曼散射增强多达14个数量级,甚至可以检测单个分子。1,2增强是由高电场强度(或“热点”)在纳米粒子表面上的位置处产生,因此也高度依赖于纳米粒子的几何结构、表面特征和分子的特定位置。显示来自关联分子SERS(SERS纳米标签)的金属纳米粒子已被用于一系列生物医学标签,以及包括免疫测定、核酸序列检测、体外细胞成像、体内成像和流式细胞术在内的平台。
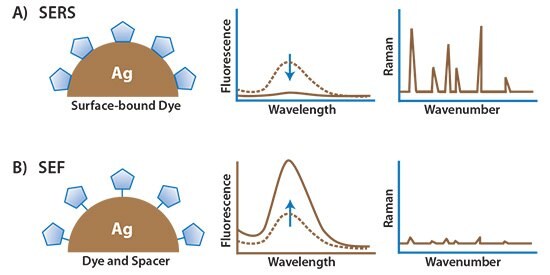
图 3.A)直接附着于金属基底的有机荧光团通常有淬灭荧光但具有很强的表面增强拉曼光谱(SERS)。B)将荧光团从金属表面分离出来导致了表面增强荧光(SEF)。
增加的局部场延伸到纳米粒子的表面之外,并且通过将荧光团放置在离银纳米粒子表面很短的距离处导致的现象称为表面增强荧光(SEF)。在20世纪70年代,SEF首先被观察到,并且它可以提高荧光团发射强度的数量级。3荧光团的增强可以归因于两种效应:1)由于等离子颗粒大的吸收和散射截面导致入射光的聚焦,以及2)允许激发态以更高频率返回到基态的荧光团荧光寿命的减少。 总的来说,这两种现象减轻了有机染料分子常见的两个缺点:1)分子的低吸收截面,以及2)每个分子激发和发射的缓慢的循环时间。为了最大化荧光团的荧光增强,金属纳米粒子的光学性质和SEF纳米标签的几何结构必须仔细设计,通过精确控制金属粒子尺寸、形状、组成以及颗粒表面附近的荧光团分布。
图3中显示了用染料分子达到最佳SERS和SEF效果所必需的不同附着策略的示意图。将染料分子附着到金属纳米粒子上通常会导致发射猝灭,原因是荧光团的激发态和金属的电子态之间的能量转移。在这种情况下,由于粒子表面的高电磁场,分子的拉曼光谱会剧烈的增强(图3A)。将荧光团稍微远离粒子表面以防止荧光猝灭,并且由于高局部电磁场,导致了分子的光电发射大大增加(图3B)。
抗菌应用
银的抗菌作用可以追溯到希腊人和罗马人,他们通过将水储存在银器中来延长其可饮用性。银离子从容器壁释放,并通过银离子与重要的细菌酶和蛋白质的巯基相互作用来达到抗菌的作用。这影响了细胞呼吸作用和跨膜离子运输,病导致细胞死亡 。4,5针对银纳米粒子毒性的其他抗菌途径也被提出。银纳米粒子可以锚定并随后穿透细菌细胞壁,导致细胞膜的结构破坏。6在银纳米粒子表面产生活性氧可导致氧化应激,为细胞损伤提供了进一步的机制。7 对细菌有特定毒性的同时保持对人类的低毒性,使得银纳米粒子整合到了多种多样的产品中,包括伤口敷料、包装材料和表面防污涂料。
银纳米粒子抗菌活性的核心机制是给银离子提供了高表面积源。在水性环境中,当粒子表面溶解时,根据化学计量反应,粒子在氧和质子存在下氧化,释放出Ag +离子。
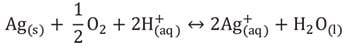
粒子表面溶解时,释放出Ag+离子。随着溶液中银离子浓度的增加,逐渐接近平衡状态并且银溶解减慢。但是,如果局部环境中存在对银具有亲和性的分子(例如巯基或氯),则溶液中游离银离子的浓度依然较低,银离子则继续从银纳米粒子中溶解。在各种不同溶液中,银纳米粒子的长期抗菌效力依赖于有效浓度银离子的维持。
银离子释放速率
银纳米粒子的银离子释放速率取决于许多因素,包括纳米粒子大小、形状、封端剂,聚集状态和环境。由于高度弯曲或应变的纳米粒子表面的高表面能,最小粒径通常具有最快的离子释放速率。形状也有助于离子释放速率。图4显示了不同大小的球形纳米粒子和银纳米片的离子释放曲线。
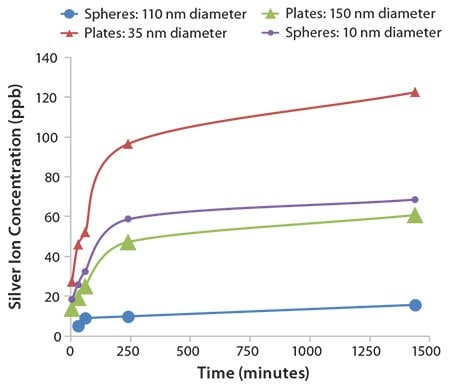
图 4.不同尺寸的银球体和纳米片随时间的银离子释放。每个样品使用相同质量的银。
正如预期的那样,较小(10nm直径)的银纳米球与较大(直径110nm)的纳米球相比,显示出明显更高的释放速率和最终离子浓度。非均质的银纳米片具有与球形颗粒显著不同的离子释放速率。平均直径为150nm的大银纳米片与10nm球形银粒子相比,几乎具有相同的随时间的银浓度分布曲线,并且35nm直径的纳米片的银离子浓度几乎是小银球的两倍。
表面的官能化也在离子释放速率中起作用,与更易于置换的稳定化分子(如柠檬酸盐)相比,紧密结合的含巯基封端剂通常会降低释放速率。粒子的聚集也会降低离子释放速率,但聚集的更大影响是由沉降引起的动力学和分布的变化。影响离子释放率最大的因素是纳米粒子环境。升高的温度,氯、巯基和氧气的存在都会影响释放速率。在一些生理介质中,银纳米粒子可以在几个小时内完全的溶解。
通过了解银纳米粒子的物理和化学性质如何影响释放速率,可以设计银纳米材料复合体,用以获得期望的离子释放曲线。这种优化非常重要,可以将所需的银数量降至最低,得到更具成本效益且对长期环境影响最小的产品。
生物成像标签和靶标
银纳米粒子拥有非凡的吸收和散射光的效率,可应用于标记和成像。纳米粒子的高散射横截面可允许单独的银纳米粒子在暗视野显微镜(图5)或高光谱成像系统下成像。8通过将生物分子(例如抗体或肽)耦合至其表面,银纳米粒子可以针对特定的细胞或细胞组分。靶向分子附着到表面可以通过吸附到纳米粒子表面上,也可通过共价偶联或物理吸附来完成。 物理吸附通常使用有易于置换封端剂(如柠檬酸盐)的银纳米粒子。通过调节pH和盐浓度,可以获得具有高亲和力和低的非特异性背景的银纳米粒子抗体缀合物。通过将抗体共价结合到表面上可以改进性能。一种共价方法是用巯基聚乙二醇分子的混合单分子层使银纳米粒子官能化,其中一部分巯基聚乙二醇含有羧酸官能团,而剩余的分子则是惰性的(甲氧基末端)。使用乙基(二甲氨基丙基)碳二亚胺(EDC)偶联,之后羧酸可以与抗体上的游离胺共价连接,产生可靶向的银纳米粒子探针
图 5.60nm直径银纳米球的暗场显微图像。
纳米医学和纳米安全
银纳米粒子在体外和体内的应用正迅速增加。除了基于银纳米粒子的超高亮度荧光标记和表面增强拉曼光谱(SERS)纳米标签之外,银纳米粒子的其他应用还包括:用作超高温的热源,以及通过粒子表面涂层来热调节药物释放。银纳米粒子也可以结合到核/壳结构中。在银纳米粒子核心上均匀生长的非晶硅壳具有可缀合到壳中的多种官能团,为壳和分子之间的静电或其他相互作用提供方法。荧光团、药物分子或其他高分子量有机分子可以整合在壳内,可应用于体外或体内标记以及药物递送。
未来,银纳米粒子的许多生物医学应用需要很好的理解纳米粒子与生物系统的相互作用。对于体内应用来说,一个主要挑战是设计具有长循环时间和低毒性的颗粒。由于纳米粒子本身及其环境的复杂性,在体内系统中优化纳米粒子性能的实验变得复杂。纳米粒子的生物命运和运输不仅取决于颗粒的主要特征(例如核心化学性质、尺寸、形状、结晶度、表面和聚集状态),还取决于依赖纳米粒子与目标生物系统相互作用的次要特征(例如蛋白冠、溶解速率、生物分布)。9只有一系列单一改良特性(例如核心化学、尺寸、形状或表面)的精确制造和良好表征的纳米材料进行的实验,才为多种性能的生物反应提供深入见解,并协助确定有效运行的最佳特征。
结论和未来展望
银纳米粒子的独特光学性质和广泛的抗菌性能导致银纳米粒子在生物中的应用迅速增加。可控制银纳米粒子的大小、形状和表面的高水平控制提供了强大的文库,不仅可以生成生物应用的功能材料,还可以用于理解生物系统中纳米粒子的运输和相互作用的基本机制。这种理解,加上更复杂的多功能银纳米复合材料的构建,使得下一代基于银纳米粒子的探针、装置和治疗成为可能。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?