用于抗体表征的酶
抗体现今是治疗药物中成长最快的类别。即使使用当今高度明确的重组人源化抗体,与功能影响有关的微异质性控制和分析通过设计范例也已成为决定质量的关键。1Alain Beck和他在Pierre Fabre免疫中心的同事们正在领导一个项目,旨在确定和定义治疗性抗体分析和质量控制的标准。2,3
在目前使用或正在研究的抗体肽和聚糖分析领域中:
- 糖型差异主要与异质N-连接聚糖种群有关
- 由几种类型的蛋白质修饰产生的电荷变体
- 氨基酸修饰,例如天冬酰胺脱酰胺、天冬氨酸异构化、和N-末端焦谷氨酸的形成
- 半胱氨酸相关变体和氧化态
- 正电荷或基本电荷补丁
- 分子量和一级氨基酸变体,包括C末端赖氨酸剪切
- 二级至四级蛋白质结构和抗原复合物变异
- 二聚化以及聚合
- 宿主细胞蛋白质污染
已经出现了几种质谱(MS)分析方法作为抗体肽和聚糖表征的核心技术。以下是一些例子:
- ESI、MALDI-TOF、Native、以及氢 / 氘交换MS方法,用于完整抗体和抗体 / 抗原复合物分析。
- LC-MS和LC-MS / MS,它们利用稳定同位素标记的肽内部标准进行抗体定量。
- 化学或酶促产生的抗体片段的中上和中下LC-MS分析。
Beck博士和其他人不仅正在研究改进现有治疗性抗体质量控制的新方法,而且正在研究生物仿制药、生物改进药和下一代抗体开发的新方法。2 Beck博士在其最近的综述文章中着重介绍了两种来自Genovis酶技术并可用于抗体特异性聚糖和肽分析的新酶:3
- FabRICATOR® IdeS蛋白酶
- IgGZERO™ (EndoS 聚糖酶)
用于改善Fc片段生成的FabRICATOR IdeS蛋白酶
历史上,抗体的肽水解使用蛋白酶,例如木瓜蛋白酶、胃蛋白酶和内切蛋白酶Lys-C,但可能会具有有限的特异性。最近,来自化脓性链球菌的降解免疫球蛋白的IdeS半胱氨酸蛋白酶(FaBRICATOR)在特异性和消化时间方面都得到了改善。由于FabRICATOR在铰链结构域下切割,具有糖基化Fab区的抗体将产生与两个单独的肽片段相关的聚糖。这使得能够进行更有效的聚糖分析,尤其是与Fc岩藻糖基化和半乳糖基化的效应子功能相关的聚糖分析。4
由于其对IgG蛋白质序列具有异常高的特异性,Goetze, A.M.等人得以利用FaBRICATOR酶切割血清中的IgG,产生Fc片段,通过LC-MS进行分析,以鉴定个体单倍型。5
使用FabRICATOR生成F(ab')2或Fab'的优点
- 消化时间更快 — 与胃蛋白酶和木瓜蛋白酶消化时间长达12小时相比,IgG在30分钟内裂解。
- 优化的配方和实验方案对IgG片段特异
- 与在可变条件下产生相同片段的其他蛋白酶相比具有更高特异性。
- 在温和条件下在生理pH下进行消化,对产生的片段的免疫反应性没有负面影响。
- 兼容FabRICATOR酶的抗体:人IgG、人源化IgG、嵌合IgG、猴、兔、绵羊、小鼠IgG2a和小鼠IgG3
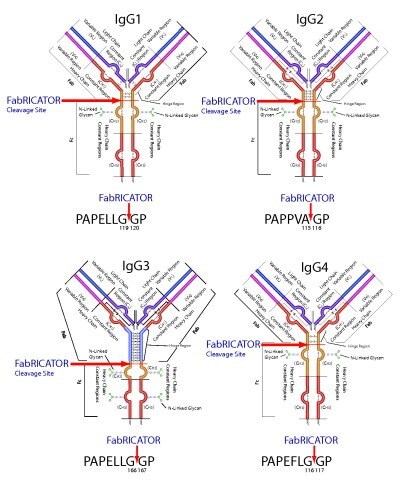
图 1.FabRICATOR在铰链区正下方切割IgG同种型,产生完整的F(ab')2片段和Fc片段。
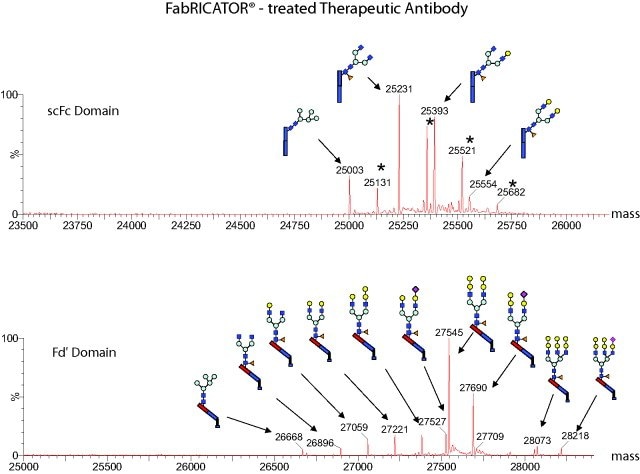
图 2.在铰链区正下方用FabRICATOR切割治疗性抗体,产生完整的 F(ab')2片段和Fc片段。对重链上具有两个不同糖基化位点的抗体,通过产生两个单独的肽片段,使每个肽片段都具有一个糖基化位点,因而简化MS分析。
用于改善N-连接的聚糖水解的IgGZERO(EndoS聚糖酶)
历史上,抗体的酶促糖链水解使用的是PNGase F等聚糖酶和其他内切和外切糖苷酶。同样来自化脓链球菌的IgGZero(EndoS)已表现出了对IgG结合的聚糖具有出色的水解活性。6,7 该酶切割来自各种来源(例如人、兔、小鼠、恒河猴、山羊、绵羊、大鼠、马、狗、猪等)的IgG上的聚糖的壳二糖核心。
IgGZERO的优点
- IgGZERO是第一种已知的细菌酶,对天然IgG具有独特的特异性,不需要对底物进行变性。其他内切糖苷酶如PNGase F的活性需要对糖蛋白底物变性,或者通过糖蛋白底物的变性来增强。
- IgGZERO这种重组酶含有N末端组氨酸标签,因此极易去除。
- IgGZERO有效切割 IgG Fc受体的结合IgG,而不会对天然细胞造成额外的损伤。
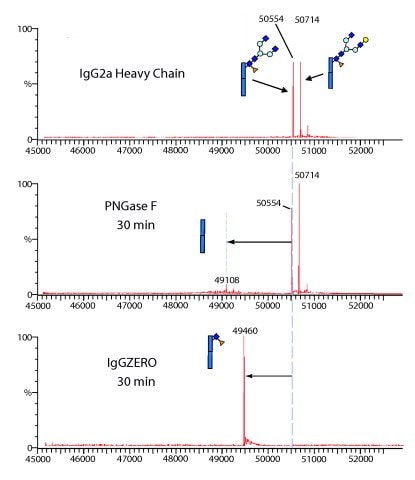
图 3.IgGZERO对天然IgG表现出特异性内切糖苷酶活性,因为它可以水解IgG重链上与Asp297连接的保守聚糖。
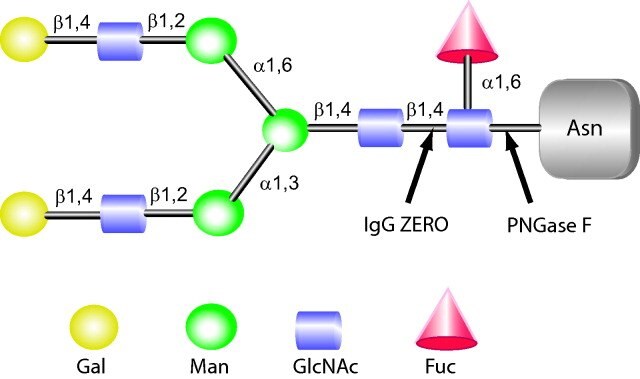
图 4.IgGZERO和PNGase F 的切割位点
总结
治疗性抗体分析正在发展,特别是随着液相色谱、电泳和MS工作流程的不断完善,更加促进了分析技术的进步。 FabRICATOR和IgGZero酶将这些方法的精确度和易用性又提高了一个台阶。
在我们的抗体表征网站上,可以更详细地了解抗体表征产品,包括Genovis酶,以及Maxi和Minispin色谱柱。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?