癌症干细胞:癌症治疗的靶标
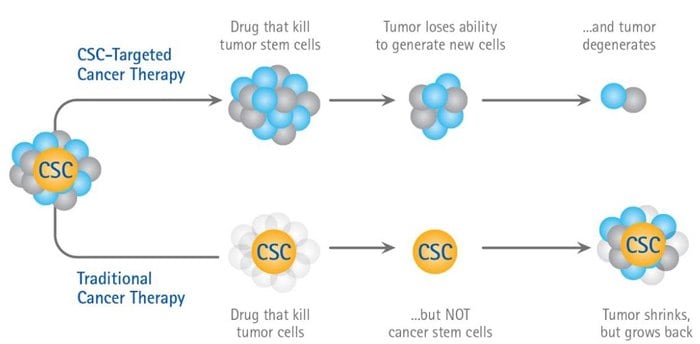
癌症干细胞假说的图示
CSC的3D球状体培养s
癌症干细胞(CSCs)在肿瘤3D微环境中寻找缺口5。体外3D肿瘤球状体内微小数量的细胞或体内肿瘤表现出“干细胞样”特征,包括1)增殖速率减缓2)具有自我更新能力和3)可经历多谱系分化的未分化表型。研究人员已经在3D球体模型和接受化疗的患者中发现可以在药物治疗后通过CSC重建肿瘤6。当对以3D球状体生长的实体瘤细胞系与单层细胞进行比较时,观察到“干性相关基因”的表达增加7。虽然这些显然不能成为CSC存在的明确证据,但这些类型的结果说明了体外3D微环境产生“干细胞样”群体的趋势,该群体非常类似于那些被认为造成肿瘤药物抗性的体内细胞群体。
癌症干细胞培养基
传统上,人们使用3D肿瘤球聚集体从癌细胞系和在含有培养基的不确定血清中进行的肿瘤活检中分离得到CSC。然而,使用不确定的培养条件会导致实验变异性和次优细胞的生长。3dGRO™球状体培养基是一种新的化学确定的和无血清CSC培养基,其支持CSC在3D肿瘤球细胞培养中的繁殖。因为肿瘤球的形成导致CSC细胞群体随时间富集,因而该培养基支持癌细胞系的连续传代。
功能和优势
- 化学成分确定的无血清配方。
- 高肿瘤球形成效率。
- 允许扩展的连续肿瘤球传代(> 10)。
- 已被证明可从众多癌细胞系中富集CSC。
经3dGRO™球状体培养基测试的细胞系
MCF-7、A-431、Panc-1、LNCaP、HT-29、A-549、U-87 MG、HT1080、E006AA
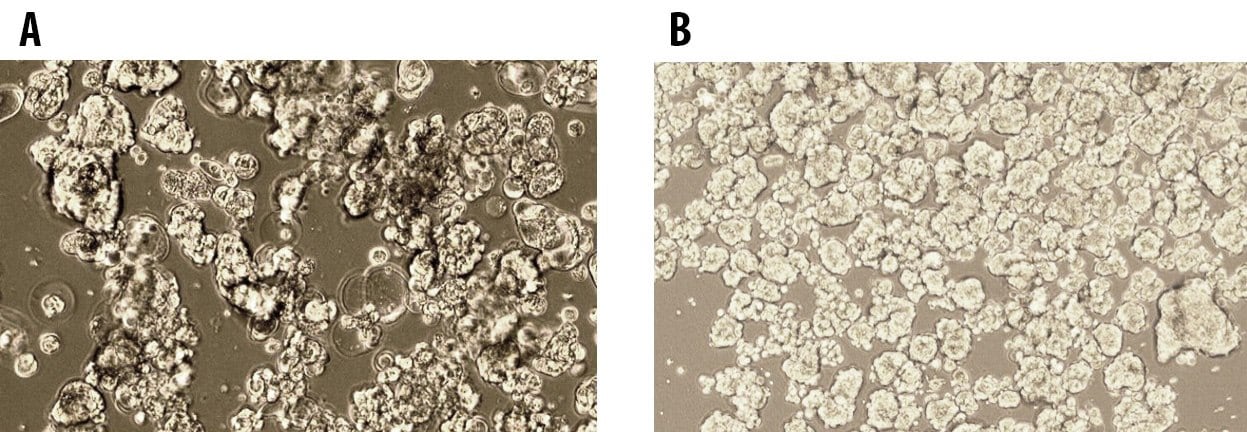
图 1.在3dGRO™球状体培养基中培养的第5代MCF7乳腺癌和E006AA前列腺癌细胞的3D肿瘤球形成。
3D球状体形成平板
Corning® Costar® 超低附着多孔板 设计用于抑制细胞附着以有效形成3D球状体,包括癌症干细胞。此平板表面涂有高度亲水和带中性电荷的涂层,该涂层与聚苯乙烯结合,可迫使种子细胞进入悬浮漂浮状态。此涂层稳定、无毒、且具有生物惰性和不可降解性。

癌症干细胞ALDH检测
CSC因其醛脱氢酶(ALDH)表达水平的升高而独特9。一直以来,ALDEFLUOR™检测被用于测量ALDH水平,并且其已对研究罕见的CSC群体具有重要影响。ALDEFLUOR检测的发射波长位于电磁波谱的绿色区域内(512nm)。因此,该试剂不能用于表达绿色荧光蛋白(发射于绿色荧光光谱)的细胞或小鼠中。AldeRed是用于ALDH的红移荧光底物,其可标记活的ALDH阳性细胞,从而可留下绿色发射通道以用于进一步的实验10。该AldeRed ALDH检测分析解决了当前ALDEFLUOR分析的局限性。
AldeRed的特性和优势:
- 红移检测可留下绿色通道以用于进一步的实验
- 活干细胞识别有利于对稀有细胞群进行流式分类
- 快速酶测定实验方案
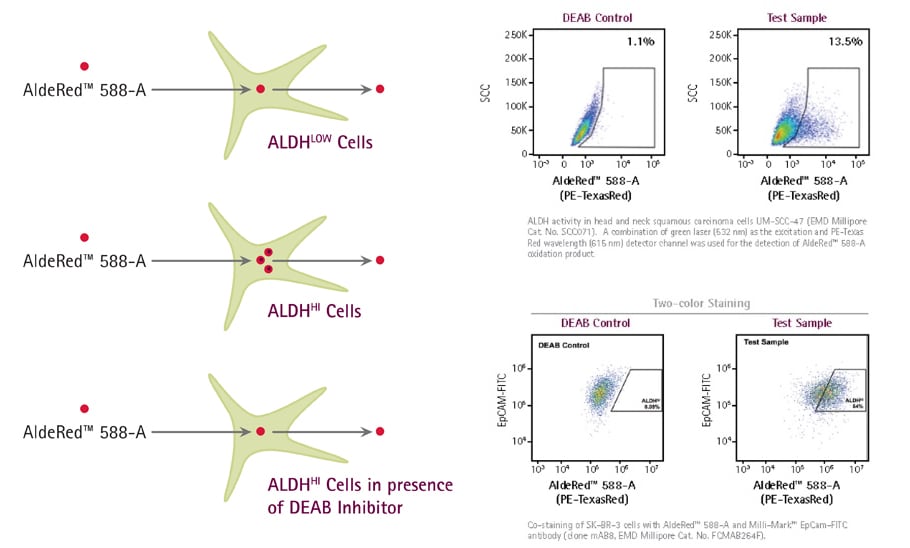
图 2.AldeRed 588-A是一种荧光且无毒的ALDH底物,可自由扩散到活的完整细胞中,但一旦被ALDH转化为相应的酸,则会被留在细胞内。
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?