基于CRISPR的基因激活
CRISPR表观编辑-dCas9
表观编辑是利用工程分子修饰基因组中特定位点的DNA或者是组蛋白。这种方法要求精确定位,因此需要使用核酸酶缺陷型Cas9蛋白(dCas9)。然而,和基因组编辑不同,表观编辑不会改变基因组DNA顺序。
p300-dCas9诱导的目标组蛋白乙酰化
组蛋白乙酰转移酶(HATs)能够实现组蛋白乙酰化。这一过程在调节染色质动力学和翻译调控中有重要作用。通过使用几类HDACs抑制剂做为抗肿瘤剂,临床验证了组蛋白乙酰化对于癌症的作用。p300/CBP是一种乙酰化转移酶(HAT),对于调控哺乳动物细胞表达有重要作用。P300 HAT蛋白质结构域(1284-1673)具有催化活性,能够和核酸酶结合,用于表观编辑。
我们发明了一种使用CRISPR,有效实现目标组蛋白乙酰化的方法。我们发现gRNA能够引导dCas9和p300HAT催化域结合,从而提高组蛋白乙酰化水平和内源基因表达。这种方法可用来研究特定基因组位点组蛋白乙酰化的功能,未来可在研究和治疗领域发挥重要作用。
dCas9-p300 CRISPR基因激活系统
dCas9-p300 CRISPR基因激活系统是基于dCas9,和人E1A相关蛋白p300的有催化活性的组蛋白乙酰转移酶(HAT)核心结构域相结合。这种方法被证明能够激活转录起始位点(TSS)近端和远端基因。该证明是由Gersbach实验室(杜克大学)独立完成的。dCas9-P300组蛋白乙酰化方法代表了相对于dCas9-VP64或其他类似基因活化基序的独特作用机制。 尽管激活域,比如VP64,能够协助转录复合体回到启动子区域,它们的作用还要取决于基因的表观状态和是否有额外的转录蛋白。相反,p300组蛋白乙酰化酶通过从异染色质状态释放DNA,开通了一条转录的高速公路,使得内源细胞机制能够持续稳定地进行基因表达,从而打开了转录通道。
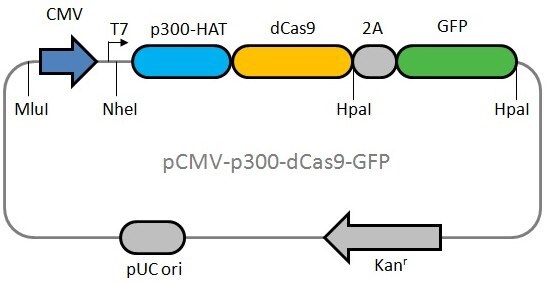
以上是表达dCas9p300融合蛋白的质粒图谱该质粒还从与dCas9p300相同的转录物中共表达和GFP蛋白能够同时转录共表达,这样就可以轻松检测目标细胞中转移和表达是否成功。dCas9p300质粒还可以与定制U6-gRNA质粒共转染,实现邻近转录起始位点或其他调控区域的目标激活。我们还提供Oct4控制质粒(CRISPR17-1EA),协助您在实验室中建立dCas9p300系统。该Oct4质粒在HEK293细胞中有效(如下图)。我们推荐同时在HEK293细胞和任何你想用的新细胞类型中测试Oct4对照质粒。

OCT4(POU5F1)是最难被激活的目标之一。
八聚体-结合TF4(Oct4,POU5F1)是维持干细胞多功能性的关键转录因子(TF)。它在恢复细胞多功能性中有重要作用。OCT4在分化细胞中一定是表达沉默。激活沉默的OCT4基因是表观重编程获得诱导多功能干细胞(iPSCs)的标志性事件。
p300-dCas9激活内源OCT4
P300 HAT结构域(1284-1673)和dCas9(D10A,H840A)结合,产生p300-dCas9系统。设计了针对OCT4的9个gRNA。和对照HEK293细胞相比,同时使用p300dCas9,9个gRNA中6个被证明能够将OCT4转录水平提高2倍或更多。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?