优化免疫荧光实验方案
获取最优质细胞图像的技巧
- 使用荧光抗体进行免疫染色
- 免疫细胞化学的荧光免疫检测:逐步解说
- 抗体和荧光染料选择
- 荧光染料选择的其他考虑
- 荧光保护计划:延长荧光抗体和试剂的使用寿命
- 抗体选择:染色法
- 抗体选择:靶向,特异反应性
- IF-ICC的实验对照
- 获得IF-ICC实验最佳信号和最低背景的专家建议
- 相关产品
使用荧光抗体进行免疫染色
免疫荧光法(IF)通过在抗体标记上荧光分子,然后使用激光器激发荧光,包括蛋白质的定位、验证翻译后修饰或活化以及与其他蛋白质的邻近和复合等操作。免疫细胞化学(ICC)是一种通过抗体结合细胞样本靶标的成熟检测技术,早在1942年Coons等人就首次描述了使用荧光报告分子的免疫检测。 除了提供关于亚细胞靶标的信息之外,联用免疫荧光和免疫细胞化学技术还可产生一些最鲜明的可视化生命科学数据。 在本指南中,抗体科学家分享了我们所知的在IF-ICC实验中获取最优质细胞图像的技巧。
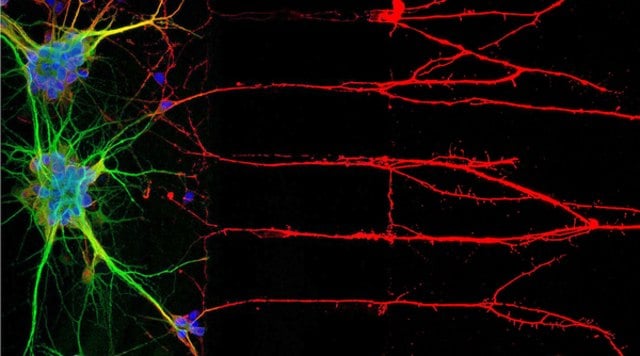
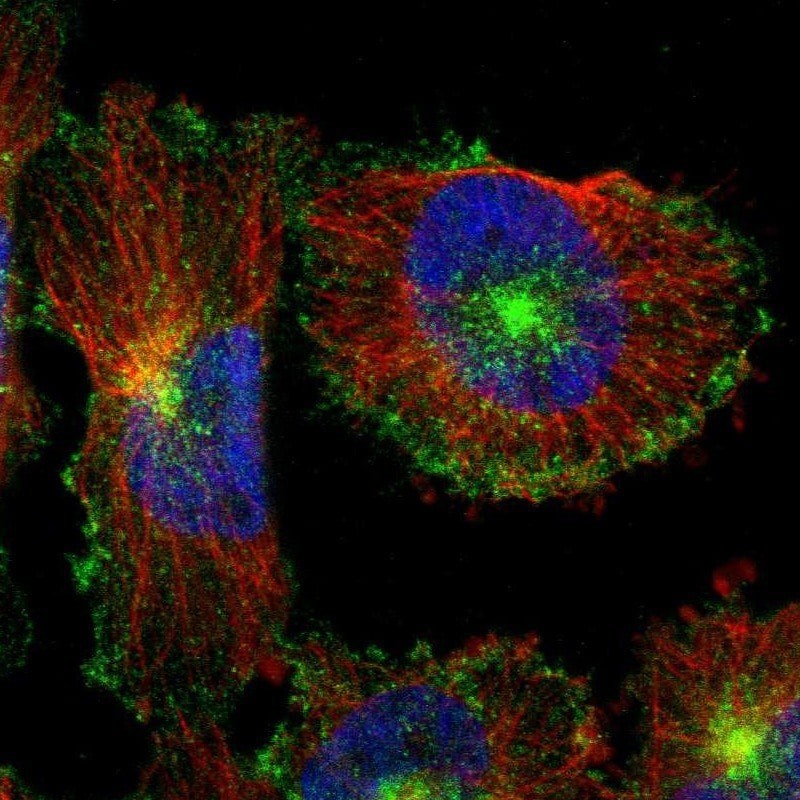
图1:免疫细胞化学法(ICC)定位神经元核、胞体和轴突相关蛋白(左)。右图为人细胞系U-251 MG的免疫荧光染色。

图 2.荧光免疫检测
为了获得最佳结果,需要根据靶标的亚细胞位置和抗原特性等因素优化免疫荧光实验方案的某些步骤。
样本制备:
无论细胞以何种方式生长,成功的IF-ICC成像均从收获培养密度适中的健康样本做起。
悬浮细胞:
这种细胞类型可先洗涤去除培养基并重悬,接着在小体积管中染色,再用载玻片封片以便显微镜检查。 为判定细胞适合用于免疫细胞化学分析,悬浮细胞要先通过显微形态检查,且密度不得超过该细胞系建议的融合度/滴度。健康的、亚融合培养物既不可过度混浊,也不能呈现代表培养基酸化的黄色。 显微检查的细胞应明亮而浑圆。可通过血球计数板和台盼蓝排斥测定细胞活力。洗涤后,细胞应按1-2 x 106细胞/mL的密度重悬,无论是用于溶液中的ICC染色,还是涂片用于随后在经过特殊处理以增强细胞粘附性的载玻片上进行染色。
当培养(或许还要处理)贴壁细胞用于靶标表达效果的IF-ICC检测时,可将细胞接种到腔室载玻片上。这种载玻片适用于于光学成像,上部粘连的单个或多个腔室可用于添加培养基。腔室载玻片中的细胞培养物可直接用于探针标记和成像。 贴壁细胞也可接种到浸入培养基的显微镜盖玻片上,再染色并在载玻片上封片用于细胞成像。
无论选择哪种培养表面和容器,都要小心监测在盖玻片上或腔室载玻片中生长的细胞,避免细胞在停止培养并固定用于免疫细胞化学分析之前过度生长。 通常在细胞融合度(细胞覆盖的比表面积)达到50-80% 时进行细胞成像。 如果在免疫染色之前必须明确测定细胞活力,某些研究人员会使用染料,如乙锭均二聚物,这种细胞核标记物不能穿过活细胞的完整细胞膜,因此需要与DAPI共同染色,DAPI在活和非活细胞中均能发出荧光,最终可按乙锭染色细胞核/双染色细胞核的比值定量计算活力。也可采用商品化的活/死细胞活力检测试剂盒,这类检测通常采用钙黄绿素和碘化丙啶分别鉴定活细胞和死细胞。
固定:
使用有机固定剂,比如乙醇和丙酮,可一步到位完成固定和透化。当靶标抗原与膜有关而必须保持脂质完整性时,则不能再使用有机溶剂。 虽然甲醛(通常以其聚合形式多聚甲醛售卖和使用)是中止降解和原位固定蛋白的常用选择,但交联的醛类分子会阻碍抗体接近某些抗原,因此应按经10-20分钟孵育即可有效稳定结构的最低浓度使用,通常为1-4%(多聚)甲醛。 注意: 由于戊二醛会产生自发荧光,最好避免在IF固定方案中使用。
抗原修复:
某些目标抗原的表位可能会由于在拥挤的细胞微环境中形成复合物或固定处理而被掩蔽。抗原修复技术已证明可提高抗体与某种靶标抗原的接触机会,但用于载玻片细胞时要万分谨慎并预先测试,因为这类技术暴露细胞的热或化学条件对于免疫细胞化学样本来说通常过于苛刻。
透化:
Triton-X或Tween-20去污剂常用于有效透化固定细胞,但这类去污剂会无差别溶解脂质,相比皂苷更具有破坏性。皂苷(saponin)是一种植物来源的糖苷,通过选择性溶解胆固醇来透化膜,细胞器膜基本上依然保持完整。如果靶标位于细胞内的膜结合结构上,更适合采用作用更剧烈的去污剂,如Triton-X、Tween-20、Brij或NP-40去污剂。皂苷是偏温和的透化剂,可保存表面抗原的完整性,但不适合用于穿透细胞内膜以便抗体接近细胞核或其他细胞器靶标。由于皂苷的作用是可逆的且会在洗涤中丧失,因此在整个染色过程中都要持续使用,确保抗体能够进入染色。
封闭:
5%的正常血清(来源于二抗生产种属)溶液可有效封闭二抗的非特异性结合。当血清不可用时,另一个适合所有二抗的方法是使用更为通用的蛋白封闭剂,比如以PBS稀释至同样浓度的牛血清白蛋白(BSA)。某些实验室会联合使用血清和BSA,以便同时完成抗体宿主特异性和通用封闭。BSA通常以冻干形式提供,经重悬成为液体,因此要过滤和/或定期检查颗粒物,以免沉积到样品上造成染色杂带。可用封闭缓冲液稀释抗体,使封闭效果在整个免疫荧光过程中持续维持。
抗体和荧光染料选择
荧光染料选择
设计任何ICC免疫荧光法细胞检测实验,首先要考虑的永远都是分析用显微镜的光学配置。 IF-ICC实验方案可标记单个靶标,但有很多荧光显微镜经过配置调试可用于多重分析,或同时染色多个靶标(包括细胞核)。三个靶标及细胞核染色实验的配色方案示例:
荧光显微镜具有光谱激发和发射的独特配置。 该显微镜出厂配有高强度光源,如弧光灯或激光器,用于发射特定波长的光线激发对应的荧光染料。滤光片组可捕获由激发的荧光染料发出的一系列波长光线,光谱范围可扩大以尽量增加可捕获的发射光,也可缩小以提高特异性并减少发射通道的光谱重叠。上表示例是基于常见的荧光显微镜配置。 用户可查询所用仪器的激光器和滤光片配置,在此基础上选择最适合免疫荧光ICC或IHC实验方案的荧光标记抗体。 显微镜中心科学家通常是免疫荧光实验设计的可靠帮手。
荧光染料选择的其他考虑
光稳定性:荧光分子在显微过程中过度暴露于环境光或激发光源会导致光漂白或不可逆的光诱导损伤,影响荧光染料的荧光发射能力。很多通用的荧光染料如FITC和TRITC的广泛供应是由于其非专有性和更长市场寿命,但与使用其他化学法的新一代荧光染料相比,它们可能对光漂白更加敏感。
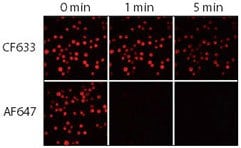
图 3.CF633和Alexa Fluor 647(AF647)山羊抗小鼠缀合物的相对耐光性。将Jurkat细胞固定、透化并用兔抗CD3染色,然后用CF633或Alexa Fluor®647山羊抗兔IgG缀合物染色。使用配备有Cy5滤光片组和CCD相机的水银弧灯显微镜对样品成像。在0、1和5分钟相继捕获图像。
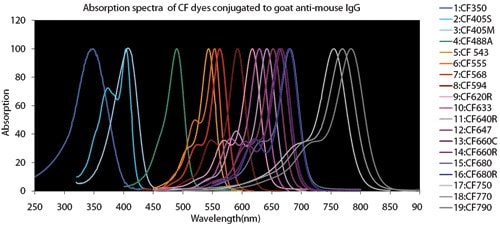
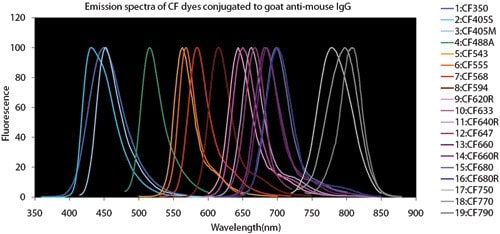
图 4.荧光染料比较图表
光谱重叠:开展多重实验分析同一样品中的多个靶标时,需要考虑荧光染料光谱特性、激光波长和显微镜滤光范围。选择显微镜发射滤光片配置时应尽量减少光谱重叠,选择不具有会漏入相邻滤光通道的长发射光谱“尾巴”的荧光染料。
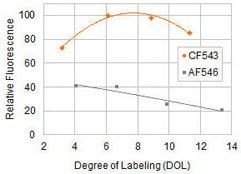
图 5.CF543和Alexa Fluor 546(AF546)山羊抗小鼠缀合物的相对荧光取决于每蛋白染料分子数(标记程度)。
抗体选择:染色法
抗体选择
直接染色法:某些研究人员可能比较偏好“直接染色”方法的便利性,这种方法将一抗与荧光染料直接偶联,可以一步到位完成结合和荧光检测,而且缩短了IF-ICC实验方案的总时间。 直接标记物还无需选择不同宿主来源的一抗以免交叉反应,方便同一样品多个靶标的多重染色(多重IF-ICC详情如下)。
使用一抗标记物时,染色应在暗处进行,以免荧光染料被光漂白。完成一抗标记物的孵育后,可立即洗涤和封片。可使用抗体混合物一步完成样品中多个靶标的染色。
间接染色法:在“间接”免疫检测中,未标记一抗特异性结合靶标后,紧接着使用针对一抗宿主物种的荧光标记二抗。 该方法具有独特的信号放大优势,因为单个一抗可以结合多个荧光标记二抗,扩大了抗原部位的荧光发射分子数目。
如前所述,采用间接检测法同时分析同一样品多个抗原时,需要考虑额外因素。
抗体选择:靶向,特异反应性
一抗:
进行间接检测时,在多重分析实验的一抗和二抗孵育步骤中均采用多种抗体的混合物。因此必须为各个靶标选择在不同宿主中生产的一抗, 确保在样品中二抗混合物的每种标记抗体都与独有(宿主特异性)的一抗结合。没能为每种靶标抗体选择独有的宿主会导致无法解释的染色结果。 下为多重间接检测实验的设置示例:
本例中,如果研究人员改为选择兔抗B一抗,抗兔二抗标记物将会同时靶向抗A和抗B两种一抗,于是靶标A和靶标B都会标记上绿色荧光信号。
一抗和组织的交叉反应性: 选择间接染色法抗体时,建议不要选择任何在样品来源宿主中生产的一抗,例如,对小鼠组织样品不要选择小鼠一抗。 如果使用了抗小鼠二抗,会导致二抗直接广泛结合组织样品,引起严重的背景染色。尽管售卖的试剂盒都旨在封闭宿主自身反应性,间接法实验风险最低的防范措施还是在选择一抗时就注意避免宿主自身反应。 注意:直接染色法通常没有宿主自身交叉反应性问题。
二抗:
如上所述(抗体选择:染色技术,间接法),“间接”IF-ICC可放大信号,因为与单个靶标结合的一抗可结合多个二抗。采用间接IF-ICC法时,实验室还可建立与不断增长的一抗兼容的二抗模块库,以便任何靶标都能分配到任何可用的显微镜滤光通道。
洗涤:
每次完成抗体或其他荧光探针反应后进行洗涤,可去除样品中的低结合亲和力抗体,从而减少非特异性信号或交叉反应。注意不要夸大洗涤步骤的重要性。 用PBS洗涤数分钟、至少换液一次,有助于去除样品中未结合的和松散结合的抗体。
延长洗涤时间可能并无明显的背景降低优势,但一般也没什么害处,只要保证在多出的时间中缓冲液不会将样品从载玻片或盖玻片中洗脱。 洗涤时间过短、重复次数变少会不能有效去除非特异性结合靶标的抗体,最终导致较差的信噪比。
细胞核复染和封片:
很多研究人员在开展IF-ICC时都倾向于使用荧光试剂来标记细胞核,比如DAPI或Hoechst。 因为这两种染料都会在到达DNA的数秒内嵌入发出荧光。可使用含DAPI的封片剂一步完成细胞核染色和封片,既能免除DAPI/Hoechst单独染色和洗涤步骤而节省时间,又可缩小细胞核复染的浓度和孵育时间差异。
所有封片剂均可将盖玻片粘附到载玻片上,并保护样品免遭脱水,以便显微镜观察。很多封片剂还优化过显微镜折射率,有的还含有试剂可以保护与染色样品结合的荧光染料,使其免遭光漂白。
IF-ICC的实验对照
同其他实验一样,设置阳性和阴性对照有助于增强ICC荧光结果灵敏度和特异性的可靠性。
IF-ICC的实验对照可包括:
省略一抗:
ICC实验有一个可轻松设置的简单对照是在间接免疫检测方案的一抗染色步骤中省略一抗。用于揭示是否有检测信号是源于荧光二抗与样品的非特异性直接结合。
同型对照:
对于使用标记一抗的直接染色法,用标记相同荧光基团的同型对照取代标记一抗,有助于确保所有检测信号都源自一抗和抗原的特异性结合。同型对照通常由抗体标记物的供应商提供,与针对抗原的抗体属于同一物种和免疫球蛋白类型,但不具有针对任何已知表位的特异性。 同型对照是一抗的对照,它们的加入可以表明检测信号并不是仅仅因为一抗蛋白本身的粘性(stickiness)(带来的非特异性结合)。
目标抗原阴性细胞:
已知不表达目标抗原的某种细胞可用作阴性对照样本。 另外,如有经基因改造无法表达目标蛋白的细胞(敲除细胞)也可作为靶标特异性的有力对照。可采用CRISPR/Cas核酸酶等基因改造技术敲除目标蛋白表达,构建阴性对照细胞系。
目标抗原阳性细胞:
如有已证明可表达目标抗原的细胞,无论是内源性还是通过修饰“敲入”或过表达基因,细胞都可用作阳性对照,用于确认当靶标存在于样本中时,染色实验方案能产生信号。
获得IF-ICC实验最佳信号和最低背景的专家建议
- 尽可能选择有ICC应用结果数据证明的抗体
- 荧光抗体的光谱特性应适配显微镜的激光器和滤光片
- 待固定的细胞样本应健康、无污染和沉淀并处于亚融合状态
- 固定和透化方法的优化依赖于靶标及其亚细胞位置
- 用封闭液稀释抗体以便在整个染色过程中维持封闭效果
- 间接检测法的荧光二抗可用于信号放大
- 在光谱特性相似的抗体偶联物中选择时,选择最稳定的荧光基团以避免长时间或重复的显微镜暴露造成的光漂白,同时注意避免光谱重叠
- 永远要记得设置适当的染色对照 如有可能,请使用阳性和阴性生物对照。
相关产品
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?