三期试验与生产

设施设计
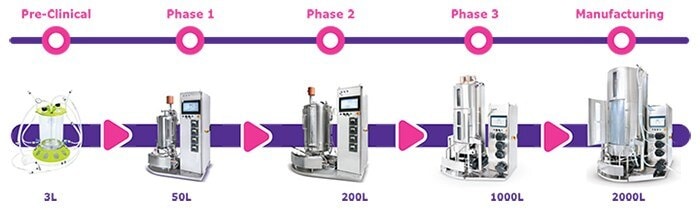
为了提高操作灵活性,一次性生物反应器平台可以帮助您从小批量扩展到完整的生产能力。在设计和建设一次性产品生产施设中,为了能生产从临床研究到大规模上市产品生产的整个过程中具有生物相似性但却不同的单克隆抗体,存在许多困难。
适当的资源支持可让您心无旁骛,集中精力发现患者可能亟需的创新药物。选择任一开发阶段以了解更多信息。或点击产品和服务链接了解相关支持资源,在初创前期抢得立享的机会。
相关网络研讨会
正确做法:mRNA生产范例
通过本网络研讨会的深入探讨,发现mRNA的潜力及其生产流程和设施的设计是如何影响可再现性和性能的。
驶入病毒载体的快车道:AAV生产的加速
观看我们的网络研讨会,了解模板病毒载体工艺如何加速AAV生产,并通过高通量筛选和转染改良提升效率。
我们可以提供哪些帮助
如有任何疑问,请提交客户支持请求
或联系我们的客户服务团队:
发送电子邮件至 custserv@sial.com
或致电 +1 (800) 244-1173
更多支持
- 计算器与应用_缓冲液计算器_HPLC方法转换计算器-默克生命科学
默克该工具箱包括用于化学、生命科学、材料科学等方面的科学研究工具和资源。
- Customer Support Request
Customer support including help with orders, products, accounts, and website technical issues.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
登录以继续。
如要继续阅读,请登录或创建帐户。
暂无帐户?







