MILLIPLEX®多重检测试剂盒在抗SARS-CoV-2人免疫球蛋白抗体检测中的应用
SARS-CoV-2冠状病毒是人类新冠病情的病因。这种病毒颗粒由核衣壳蛋白(N)包被的RNA组成,而核衣壳蛋白又为膜蛋白所包裹。围绕这一内核的冠状突刺蛋白由亚单位S1和S2以及与人类细胞血管紧张素转换酶 2 (ACE2) 受体的受体结合域(RBD)组成。 受体结合后,病毒进入细胞内,接管细胞结构并进行繁殖,进而继续传染。病毒的结构蛋白为引起免疫反应提供抗原潜能。病毒感染后,体液免疫系统做出应答,首先产生免疫球蛋白IgM,然后产生IgG,从而形成长效免疫。IgA是一种粘膜免疫反应的产物,也存在于血液中。
研究人员通过检测人体血清和血浆中与SARS-CoV-2抗原结合的IgM、IgG和IgA抗体的含量,可识别出接触过SARS-CoV-2病毒且产生一定程度免疫反应的研究样本。还可进一步了解COVID-19感染和恢复过程中的免疫反应情况。
我们的三种可配置 4 重检测试剂盒(货号HC19SERM1-85K、HC19SERG1-85K和HC19SERA1-85K)均允许研究人员选择以下任一或所有病毒抗原:SARS-CoV-2 Spike S1、Spike S2、RBD 和 N 蛋白。
阅读我们的应用说明。了解我们的MILLIPLEX® 多重研究试剂盒如何检测识别人血清和血浆中的 SARS-CoV-2 抗原蛋白抗体。
仅供研究使用,不可用于诊断。
示例数据
根据MILLIPLEX® SARS-CoV-2 试剂盒( IgG、IgA 和 IgM )各自的操作方案,对 EDTA 血浆样本的所有四种分析物 S1、S2、RBD 和 N 进行检测(一式多份)。样本来自PCR检测SARS-CoV-2阳性或阴性患者组:COVID-19 阳性“通风”(n=68)、COVID-19 阳性“未通风”(n=115)和 COVID-19 阴性“COVID-”(n=41)1。图形分析结果显示了每组中每个样本的单独 MFI和组平均值,+/- 标准偏差 (SD),以及组间p 值显著性结果:****p<0.0001,***p<0.001,**p<0.01,*p<0.05。
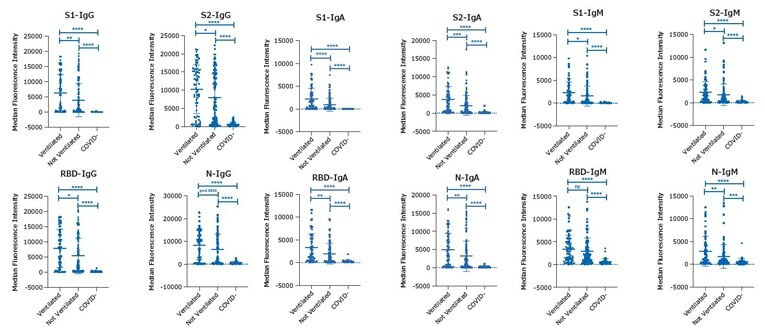
图 1.使用 MILLIPLEX® SARS-CoV-2多重检测试剂盒( IgG、IgA 和 IgM )和EDTA 血浆样本分析 S1、S2、RBD 和 N四种分析物的数据。
MILLIPLEX®多重检测试剂盒用于细胞因子风暴相关COVID-19研究
当免疫系统对病原体或其他免疫原性物质(如药物)产生过度反应时,过度炎症反应可触发免疫细胞产生过量的信号分子。这一现象即为细胞因子风暴综合症或细胞因子释放综合症。该急性或全身性炎症可导致肺部积液、呼吸窘迫、多器官衰竭甚至死亡。
人体研究
最近关于 COVID-19 细胞因子概况的出版物发现,M-CSF、IP-10、IL-1RA、IL-10、IL-15、IL-27、TNFα 和 IL-8 水平升高可预测细胞因子风暴或与更严重的疾病相关2,3。一项分析研究发现,除IL-18、IP-10、MIG等外,IL-6、IL-8、TNFα 和 IL-10 的循环水平也与COVID-19 重症相关4。
非人灵长类动物研究
目前,关于SARS-CoV-2的研究也正在猕猴等非人灵长类动物身上进行,让研究人员能够在相关动物模型中测试可能的疫苗和抗病毒药物/治疗方法的效果。最近使用MILLIPLEX®非人灵长类试剂盒进行试验的一篇Nature文章,分析了暴露于SARS-CoV-2的猕猴在多个时间点的血清中细胞因子和趋化因子水平的变化。研究显示IL-IRA、IL-6、IL-10、IL-15、MCP-1、MIP-1β增加,TGFα减少5。我们的MILLIPLEX®非人灵长类动物细胞因子/趋化因子/生长因子检测试剂盒A可同时定量血清、血浆和细胞/组织培养上清液样品中的 48 种免疫因子。您可自选任意分析物组合、定制预混液,或选择 38 重或 48 重预混试剂盒。
使用MILLIPLEX®多重免疫检测试剂盒了解COVID-19的免疫反应
我们的MILLIPLEX®多重免疫检测试剂盒可帮助研究人员对大量分析物进行同步定量分析,以更好地理解人类免疫反应。我们的48-plex人细胞因子/趋化因子/生长因子试剂盒A可实现细胞因子风暴、败血症等疾病中细胞因子变化趋势的快速检测,大大节省操作时间和样本量。我们提供各种各样的MILLIPLEX®可溶性蛋白和细胞信号试剂盒,可在抗病毒免疫反应研究中帮助阐明下游信号通路的状况。我们的产品组合提供适用于大多数物种的分析物,包括用于疫苗研究的非人灵长类动物检测试剂盒。
仅供研究使用,不可用于诊断。
使用MILLIPLEX®人细胞因子试剂盒A对脓血症组和正常对照组血清/血浆样品进行的对比
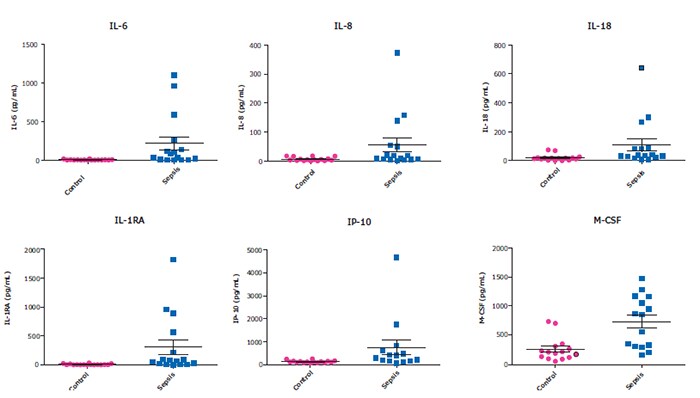
图 2.使用HCYTA-60K试剂盒对健康对照组(n=20)和脓血症患者(n=16)的血清/血浆样品(取自BioIVT、Discovery和 BioChemed)中炎症因子浓度进行检测,25µL/孔。此处所示为近期报道在SARS-CoV-2细胞因子释放综合症(CRS)研究中浓度上调的部分分析物。
仅供研究使用,不可用于诊断。
MILLIPLEX®多重检测试剂盒用于新兴COVID-19研究领域
ACE 和 ACE2参与血浆激肽释放酶-激肽系统(Kallikrein-kinin system,KKS),负责控制凝血系统、内皮细胞生长、血管生成、补体途径和肾素血管紧张素系统(RAS)6。缓激肽是一种激肽,与激肽释放酶和激肽原共同构成KKS。ACE2 的作用是减少缓激肽——其受到干扰时,过高的缓激肽水平会加剧全身炎症7。除 CSS 外,RAS/KKS 受到破坏也可能导致 COVID-19 出现严重并发症。此外,缓激肽受体活化会介导炎症,导致细胞因子水平明显升高。我们的MILLIPLEX®多重免疫检测试剂盒让研究人员能够同时定量多种对于了解对COVID-19触发机制至关重要的分析物——这类产品包括我们的人类补多重检测试剂盒1(货号HCMP1MAG-19K)和2(货号HCMP2MAG-19K)、肾素、激肽释放酶-6,以及我们的人类血管生成/生长因子多重检测试剂盒1(货号HAGP1MAG-12K)和人类血管生成多重检测试剂盒 2(货号HANG2MAG-12K)。
凝血病是一种与 COVID-19 相关的严重疾病,症状为D-二聚体水平升高,同时肺部尸检广泛存在微血栓8。血栓并发症与多器官衰竭和高致死率有关。急性期蛋白(如 CRP 和纤维蛋白原)水平升高经证与 COVID-19 的严重程度相关。细胞因子水平升高是此前提到的疾病指标,可导致粘附分子(如 ICAM-1、VCAM-1、P-选择素和 e-选择素)上调9。使用我们的 MILLIPLEX®人心血管疾病多重检测试剂盒(货号HCVD2MAG-67K),可以同时定量 ICAM-1、VCAM-1、D-二聚体和 P-选择素,研究这一重症。
您的研究突破离不开可靠的高性能产品和服务。我们的 MILLIPLEX®多重免疫检测试剂盒是极其丰富的生物标志物多重分析产品线,基于Luminex® xMAP®技术,可为您提供一致的高质量结果,让您在节约时间、人力和成本的同时,尽善尽美地完成研究工作。
仅供研究使用,不可用于诊断。
有关MILLIPLEX®多重检测试剂盒的COVID-19专题研讨会
观看我们的点播式研讨会,了解MILLIPLEX®多重检测试剂盒如何用于COVID-19研究。在此系列网络研讨会中,您将了解如何评估 COVID-19 患者的免疫响应,以及如何将多重免疫检测试剂盒成功融入自己的疾病研究工作流程。
- SARS-CoV-2 的 IgG 抗体与 COVID-19 阳性患者出现症状的天数相关; 弗吉尼亚大学医学院的 Mary Young主讲
- COVID-19 患者 SARS-CoV-2 特异性抗体响应动态; 汉诺威移植免疫学研究所 Christina S. Falk 博士教授主讲
- COVID-19重症患者的免疫响应; 北京市肝病研究所陈德喜教授主讲
- MILLIPLEX®多重免疫检测试剂盒用于 COVID-19 和细胞因子风暴研究; MILLIPLEX®产品经理 Brooke Gilliam 主讲
- IL-13 是 COVID-19 的致病驱动因子; 弗吉尼亚大学 Alexandra Donlan主讲
- 拒COVID-19于门外:SARS-CoV-2的既有和诱导抗体免疫; 由Children’s Mercy Research Institute研究所 Todd Bradley 博士主讲
您的论文中是否涉及我们的MILLIPLEX®产品?
如何在论文中引用我们的产品
准备好发表了吗?很高兴您使用我们的产品帮助推进自身研究!
如何引用MILLIPLEX®多重检测试剂盒:
- 如果您身处美国或加拿大,请宣称MilliporeSigma是您的检测试剂盒来源。
- 如果您身处美国或加拿大以外的全球其他国家/地区,请宣称德国达姆施塔特默克公司是您的检测试剂盒来源。
- 要说明完整的MILLIPLEX®试剂盒名称和试剂盒货号,并列出您使用的试剂盒对应的分析物。
- 还要说明您使用的样品种类以及稀释方法。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?