使用X-tremeGENE HP转染试剂进行慢病毒生产
慢病毒是一种用于在研究应用中转染多种细胞类型的强大工具。在病毒生产期间,实现低滴度和毒性绝非易事。这里介绍的一种易用方案使用X-tremeGENE HP转染试剂进行快速而稳健的慢病毒制备,从而获得高病毒滴度以实现成功的靶细胞转染。
材料
- 包装细胞系
TLA-HEK293T (Open Biosystems) 该细胞系粘附生长,适用于无血清培养基配方。使用X-tremeGene HP试剂时,不需要适应无血清条件,因为该试剂不会因血清的存在而受影响。细胞应在含有GlutaMAX(Invitrogen)和10%胎牛血清(FBS)的Opti-MEMR中进行培养。将培养容器保持在37℃,10%CO2和95%RH条件下。 - 表达载体
pGIPZ (Open Biosystems),或与表达eGFP或其他合适转基因的第二代/第三代慢病毒包装系统相容的其他载体。 - 包装和包膜质粒
psPAX2和pMD2.G质粒能够表达产生功能性病毒颗粒所需的蛋白质,对重组具有抗性。
方法
A.慢病毒上清液生产
第1天
- 用1mL浓度为0.01mg/mL的无菌聚赖氨酸水溶液涂覆在标准6孔细胞培养板的孔上。在室温下孵育至少1小时(+15至 +25 °C)。
- 用2 mL无菌水洗涤每个孔两次。
- 在无菌条件下移出水,并对容器进行空气干燥。
- 在转染前一天将TLA-HEK293T细胞以约40-50%的融合度分别加至包被的孔板中,并将细胞置于2 mL生长培养基(含有GlutaMAX、10%FBS的Opti-MEMR)中生长。
第2天
- 取出旧的培养基,并加入1.8 mL新鲜培养基。
- 准备转染混合物:
A)将表达载体(pGIPZ)、包装载体(psPAX2)和包膜载体(pMD2.G)按摩尔比1:2:2混合,溶于无菌水或TE缓冲液(pH 7.6)至2μg(0.53μg;0.95μg;0.52μg)。
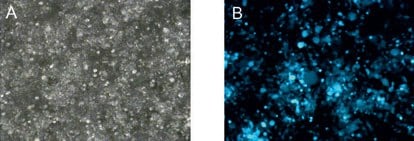
图 1.48小时后的转染效率。使用X-tremeGENE HP转染试剂将大量病毒质粒递送至包装细胞中。(A)明场显微镜,(B)荧光显微镜。
注意:制备得到的质粒应该是高质量且不含内毒素的。
B) 将DNA稀释至0.2 mL转染培养基(无血清Opti-MEM®培养基)中。
C) 加入6 μL X-tremeGENE HP试剂,短暂涡旋并在室温下孵育15分钟。
3.小心地将转染混合物添加至细胞中,并轻轻搅拌以实现化合物的均匀分布。
第3天
用2 mL生长培养基替换旧培养基。注:弃去的培养基中含有少量病毒颗粒,应根据生物安全等级2作为废物处理。
第5天
- 收集含有病毒的上清液并将其转移到1.5 mL无菌小瓶中。
- 在-2至-8 °C下以2000×g离心10分钟,并将上清液转移至新小瓶中。
B.通过有限稀释确定病毒滴度
第1天
在体积为200 μL的生长培养基中,在聚赖氨酸包被的96孔板的每孔中加入1×104个种子细胞(这里也是TLA-HEK293T)。
第2天
- 将40 μL含病毒的上清液加入160 μL含有8 μg/mL聚凝胺的生长培养基中。
- 用另外的90 μL含有聚凝胺的生长培养基稀释10 μL所得病毒溶液。重复该稀释过程至少5次。
- 除去培养基后,向细胞中加入100 μL稀释液(细胞生长至约60%融合)。
- 1小时后,每孔加入另外100 μL生长培养基。
- 转化48小时后对细胞进行分析。对GFP阳性细胞进行计数并乘以稀释因子。
结果
为了确定该方案是否产生适合细胞培养的足够纯和浓缩的病毒,根据上述方法转染细胞。显微镜分析清楚地显示出高水平的GFP表达(<90%),且没有毒性(图1)。
此外,使用产生的含病毒的上清液进行转染后的显微镜分析显示GFP阳性细胞的产量为1.2 x 106 pfu/mL。因此,此处建立的实验方法能够生产合适量的慢病毒。为避免病毒DNA多次插入宿主基因组,建议以低于0.1的感染复数(MOI)感染细胞。利用该实验方法从标准6孔板的一个孔中所获得的病毒量,可用于转染至少107个细胞。
仅用于生命科学研究。不可用于诊断流程。
材料
Loading
登录以继续。
如要继续阅读,请登录或创建帐户。
暂无帐户?