硫代磷酸寡核苷酸
我们开发了几种磷酸盐骨架变体,以试图改变天然状态DNA的化学性质,从而克服体内使用寡核苷酸所涉及的两个主要挑战,即:1)通过质膜递送到细胞内部(质膜是一种没有转运蛋白的脂质双层,对大部分极性分子是不可渗透的),以及 2)通过最小化细胞外和细胞内核酸酶降解来延长有效分子寿命。
最初的和目前仍是最广泛使用的骨架变体之一是硫代磷酸盐(当掺入寡核苷酸时通常称为S-oligo,图1)。已经发现硫代磷酸盐通过降低多种细胞外和细胞内核酸酶的活性,来帮助减轻与体内使用寡核苷酸相关的第二个主要挑战1。
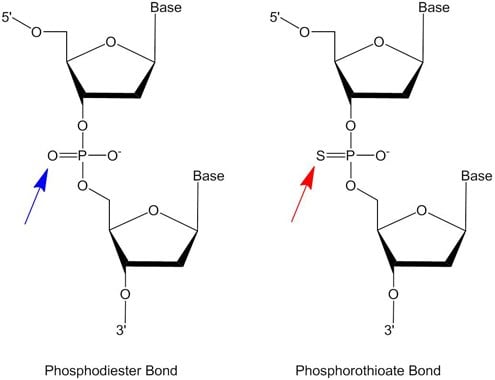
图 1.磷酸二酯和硫代磷酸盐的核苷酸间键。天然状态DNA寡核苷酸中的糖基团通过磷酸盐连接(包括一个非桥氧,用蓝色箭头突出显示),而用硫化试剂修饰的寡核苷酸中的糖基团通过硫代磷酸盐连接(包括一个非桥硫,用红色箭头突出显示)。
这些特征使硫代磷酸盐有效地产生用于反义敲低的寡核苷酸,这是早期乃至现在仍在追求的核酸治疗技术之一2。硫代磷酸寡核苷酸通过与靶mRNA杂交来下调基因表达,而靶mRNA又抑制mRNA成熟,使RNA酶(RNase)H介导的转录物降解,或者阻断翻译3。
除了体内技术(例如反义)之外,硫代磷酸盐现在经常与体外技术一起用于类似的目的,即防止溶核降解。例如,下一代测序接头寡核苷酸通常在一个3'-末端核苷酸间键被修饰,以防止被文库制备过程中使用的酶降解4。
物理特性
虽然硫代磷酸盐核苷酸间键对核酸酶具有抗性,但是引入太多这样的键会降低寡核苷酸的功能,特别是对于反义寡核苷酸。这是因为在合成过程中使用的硫化过程产生立体异构的α-磷原子(图2),这导致非对映异构体(长度为n的寡核苷酸的2n-1构型)。这些类型的立体异构体具有各不同的功能特性,其中一些对反义产生负面影响。然而,通过适当掺入修饰物,可以使非对映异构体的潜在负面影响最小化。
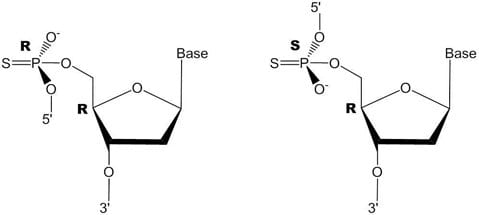
图 2.一个核苷酸间键的立体异构α-磷。随机R和S构型产生非对映异构体。
掺入指南
由于修饰核苷酸间键的作用通常是不可预测的3,因此设计有效的硫代磷酸盐寡核苷酸以抵抗降解通常是个试错过程(请参见图3的示例序列形式)。在整个寡核苷酸中不一定必须存在硫代磷酸盐键,但应考虑以下因素:
• 为抵抗外切核酸酶,寡核苷酸应在5'和3'末端附近具有硫代磷酸盐键
• 为抵抗内切核酸酶,寡核苷酸应在整个序列中具有硫代磷酸盐键
应使用最低掺入量(通常通过实验确定)防止非对映异构体混合物带来的负面影响,包括:1)干扰寡核苷酸:由较低解链温度 (Tm)引起的靶标杂交热力学 — 这由某些增加分子刚性的构型的空间位阻造成的;2)脱靶结合 — 过量的硫代磷酸盐键可能使寡核苷酸“粘稠” — 可能会导致虚假的反义效应,从而增加细胞毒性的可能性。
ACGTACGTACGTACGTACGT A*C*G*TACGTACGTACGTA*C*G*T
磷酸二酯寡核苷酸 硫代磷酸寡核苷酸
图 3.具有相同序列的磷酸二酯和硫代磷酸盐寡核苷酸的缩短序列形式的示例。硫代磷酸盐核苷酸间键用星号表示。可以看出,该序列具有最低量的掺入,并且被设计用于防止假设的外切核酸酶。
此外,当需要具有修饰的硫代磷酸盐寡核苷酸时,重要的是要考虑到反应物的化学计量可能会降低,这导致其最低产量低于仅有硫代磷酸盐的寡核苷酸的情况(关于使用只有硫代磷酸盐的寡核苷酸以及使用修饰后的硫代磷酸盐的寡核苷酸这两种情况下的各自最低产量,请参见标准DNA合成和定制DNA寡核苷酸修饰)。
纯化方法
硫代磷酸寡核苷酸适合用HPLC纯化,对硫代磷酸寡核苷酸进行纯化是有益的,因为硫代磷酸寡核苷酸常用于体内技术,具有尽可能高的同质性是必须的,可以避免细胞毒性作用、脱靶结合等问题。然而,其HPLC峰值比磷酸二酯寡核苷酸的峰值宽,原因是硫代磷酸盐寡核苷酸有较大倾向形成二级结构以及含有非对映异构体混合物(请参见硫代磷酸寡核苷酸的色谱图分析)。
结论
硫代磷酸盐可以有效降低体内和体外技术所需的寡核苷酸的溶核降解。有多种合成规模比例和纯化技术可用,以满足各种研究和应用需求。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?