使用Imprint® RNA免疫沉淀试剂盒Ago RIP分离microRNA及其靶标
如技术公告所述,Imprint® RNA 免疫沉淀试剂盒用于从 HeLa 细胞中共纯化人 argonaute 2 (Ago2) 相关 RNA。为了评估该试剂盒可能的不同苛性选项,测试了温和和苛性裂解缓冲液,通过向试剂盒的洗涤缓冲液中添加 0.95% Igepal 和 0.75 M NaCl 补充试剂盒提供的温和洗涤缓冲液(终浓度 = 1% Igepal, 0.9 M NaCl),制备更苛性的洗涤缓冲液。每次 RNA 免疫沉淀 (RIP)用温和或苛性裂解缓冲液裂解 200 万个 HeLa 细胞,用 2.5 µg 阴性对照抗体 (IgG; I4131)或Ago2 特异性抗体 (SAB4200085)进行免疫沉淀,并用试剂盒随附的温和洗涤缓冲液或按上述方法制备的苛性洗涤缓冲液洗涤。所用Ago2抗体(SAB4200085;克隆 11A9)的特异性及其对免疫沉淀的适用性此前已由Amear-Zazoua 等人在2012年(Nat Struc Mol Biol 19, 998; Figure 3c.)通过蛋白质印迹(进行/未进行Ago2敲低)验证。由于Ago2 抗体 SAB4200085是通过大鼠产生的单克隆抗体,因此使用兔抗大鼠(R9255; 2.5 µg)IgG 作为与试剂盒的 Protein A 磁珠的桥接抗体。在每一裂解和洗涤组合条件下进行两次免疫沉淀(轻度裂解/温和洗涤,图 1;温和裂解/苛性洗涤,图 2;苛性裂解/温和洗涤,图 3;苛性裂解/苛性洗涤,图 4)。纯化 Ago2 相关 RNA 后,使用 MystiCq® microRNA cDNA 合成混合物(MIRRT)、MystiCq® microRNA® SYBR® Green qPCR ReadyMix (MIRRM01)和 3种miRNA(hsa-let-7c (let7c)、hsa-miR125a-5p (miR125a)和hsa-miR191-5p (miR191))和2 种对照小 RNA(RNU6 和 SNORD48)的MystiCq 引物进行 RT-qPCR。利用ReadyScript® cDNA 合成混合物(RDRT)、KiCqStart® SYBR® Green qPCR ReadyMix™ (KCQS01)和KiCqStart引物检测 3 种 mRNA(DICER1、MYC 和 GAPDH)。
预期所有 miRNA 均与抗 Ago2 抗体结合并共免疫沉淀。此外,DICER1 和 MYC 都是已发表的 let7c 靶标(Carcinogenesis 29, 2073;BMC Mol Biol 8, 79),因此应通过 Ago 2 RIP 回收。而HeLa 细胞中的 GAPDH确知不会被任何 miRNA 靶向,因此可作为非靶向阴性对照。尽管一些小核 RNA 经证与 Ago2 结合并共免疫沉淀 (Nat Struc Mol Biol 19, 998),但 RNU6 并不在报道的 Ago 2 相关小 RNA 之列。此外,在已发表文献中,采用分离的细胞核染色质组分进行 RIP。对于此处使用的全细胞提取物,这种相互作用太细微,无法检测到。据相关报道,源自几种小核仁 RNA 的小 RNA 可以与 Ago2 共免疫沉淀,并发挥 miRNA 类似功能 (Mol Cell 32, 519)。但 SNORD48 并不在报道的小核仁 RNA 之列。因此,let7c、miR125a、miR191、DICER1 和 MYC 均应在 Ago 2 RIP 中检测到,而 RNU6、SNORD48 和 GAPDH 则不会检测到。
如图 1-4 所示,无论使用哪种裂解和洗涤条件组合,用于此评估的 RIP 都非常简洁。A 组显示了检测到高水平 miRNA 的结果,B 组显示了检测到的低水平非靶标对照 RNA 和 mRNA 的结果。两者均以输入 RNA 的百分比表示。使用 Ago2 特异性抗体回收的 Ago2 靶 RNA(let7c、miR125a、miR191、DICER1 和 MYC)比非靶 RNA(RNU6、SNORD48 和 GAPDH)多 2.5 至 105 倍以上。此外,与非特异性 IgG 相比,Ago 2 RIP 中的靶标 RNA 浓度提高了 100 至 10,000 倍,而非靶标 RNA 浓度提高了 0.4 至 24 倍。请注意,let-7c 和 miR-125a 的确切输入百分值并不可靠。在免疫沉淀之前仅保留 8% 的细胞裂解物并用其计算输入百分比,并由此推断 let-7c 和 miR-125a 的产量。
温和裂解+温和洗涤是此处使用的抗体和 RNA 靶标的最佳 RIP 条件。在此条件下获得了最高的 Ago 2 靶标 RNA 产率,并且能够充分区分靶标和非靶标 RNA。如需区分低丰度靶标RNA中的非靶标RNA,可能需要更严苛的裂解和/或洗涤条件。此处报告的结果表明,温和裂解+苛性洗涤可能更适合较低丰度的靶标 RNA。与其他裂解和洗涤条件组合相比,这一条件下的信噪比几乎达到了两倍,因此可以最好地区分靶标和非靶标(表 1)。
报告了每种裂解和洗涤条件组合下的最高和最低信噪比。如需计算最高信噪比,可将最高丰度的 Ago2 靶标 (let7c) 产量(输入百分比)除以最低丰度非靶标 RNA (SNORD48) 的产量,得到 let7c/SNORD48。同样,如需计算最低信噪比,可将最高丰度的 Ago2 靶标 (DICER1) 产量除以最低丰度非靶标 RNA (GAPDH)的产量,得到 DICER1/GAPDH。结果值四舍五入为 2 位有效数字,并单独报告两份重复 RIP 的结果(RIP#1 和 RIP#2)。
使用Ago1抗体(克隆4B8,SAB4200084)代替Ago2抗体重复上述实验。尽管在 Ago1 RIP 中检测到的 3 种 miRNA 含量高于 IgG RIP 或 Ago1 RIP 中的非靶标小 RNA,但产量远远低于 Ago2 RIP(Ago1的let7c = 输入的 0.4% 至 1.7%,而 Ago2 = 输入的20% 至 90%)。此外,与非靶标 mRNA(GAPDH;数据未显示)相比,2 种靶标 mRNA(DICER1 和 MYC)未被选择性回收。

图 1.温和裂解 + 温和洗涤下的 Ago2 RIP 的 RT-qPCR 结果
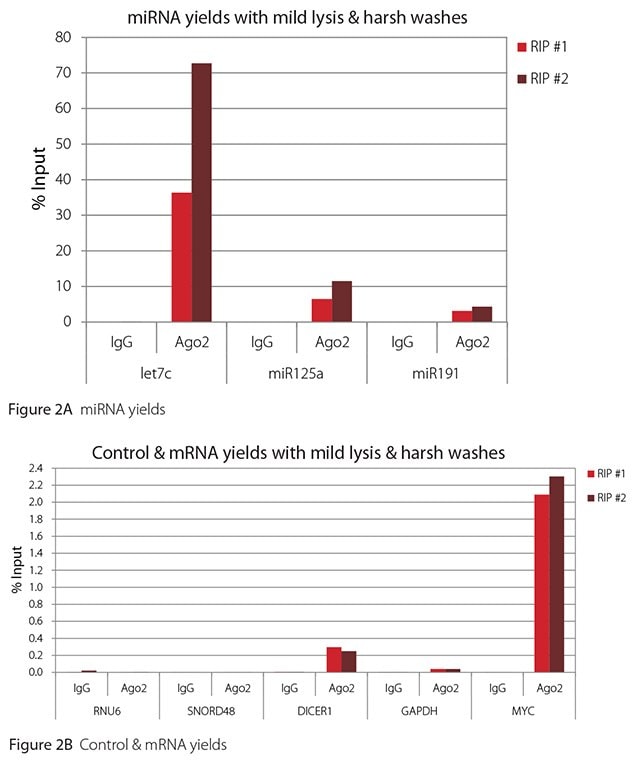
图 2.温和裂解 + 苛性洗涤下的 Ago2 RIP 的 RT-qPCR 结果
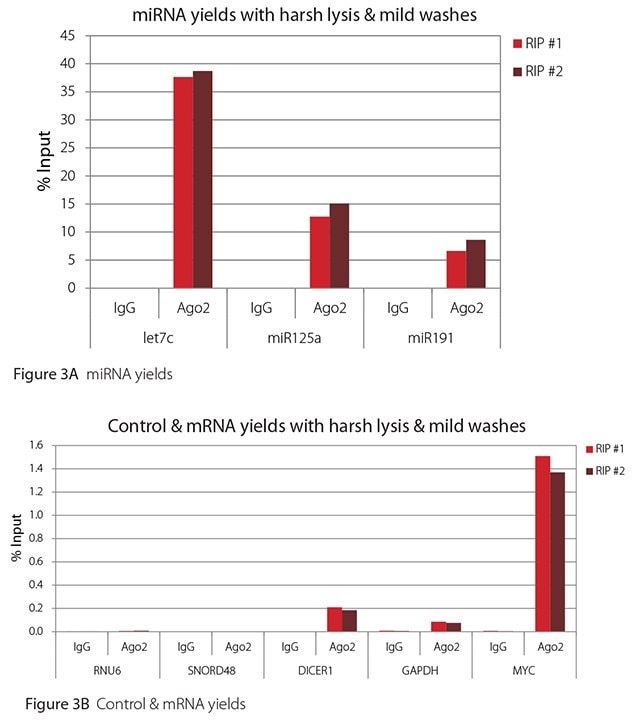
图 3.苛性裂解 + 温和洗涤下的 Ago2 RIP 的 RT-qPCR 结果

图 4.苛性裂解 + 苛性洗涤下的 Ago2 RIP 的 RT-qPCR 结果
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?