Glycosylphosphatidylinisotol-anchored Glycoproteins Overview
Glycosylphosphatidylinisotol- (GPI) anchored proteins have been identified throughout a broad range of eukaryotic species ranging from humans to insects, yeasts, bacteria, and fungi, suggesting that they are an ancient modification. In general, GPI-anchored proteins are not as prevalent as other post-translationally modified proteins, but as a class of glycoproteins, they demonstrate considerable homology.
Structure
GPI-anchored proteins are linked at their carboxy-terminus through a phosphodiester linkage to phosphoethanolamine attached to a trimannosyl-nonacetylated glucosamine (Man3-GlcN) core. The reducing end of GlcN is linked via another phosphodiester linkage to phosphatidylinositol (PI) (Figure 1).
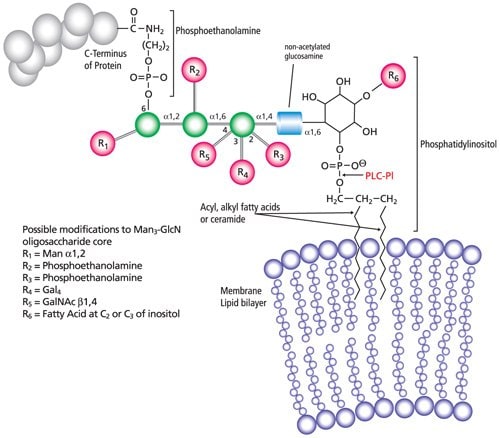
Figure 1.General structure of GPI-anchored proteins. The lipid tails of the phosphatidylinositol moiety are shown inserted through the outer cell membrane and held by the lipid bilayer.
Biosynthesis and Degradation
The GPI anchor is assembled on the membrane leaflet of the endoplasmic reticulum. Once completed, it is transferred to the lumen and the carboxy terminus of the protein is attached to the GPI anchor. After translocation across the membrane, GPI anchored proteins are bound to the cell membrane by the insertion of the phosphatidylinositol lipid moieties into the hydrophobic lipid bilayer. Once the GPI anchored protein has been produced, the Man3-GlcN oligosaccharide core may undergo additional glycosylation modifications during secretion from the cell.
Release of GPI-anchored proteins can be accomplished by treatment with phospholipase C, phosphatidylinositol-specific (PLC-PI) (P5542 and P8804). The enzyme specifically hydrolyzes the phosphodiester bond of phosphatidylinositol to form a free 1,2‑diacylglycerol and glycopeptide-bound inositol cyclic-1,2‑phosphate; the cleavage site of PCL-PI is shown in red (Figure 1). Enzymatic cleavage will not occur if the inositiol is acylated; pre-treatment with mild alkali conditions is necessary to remove the fatty acid moiety. Following enzymatic cleavage, the GPI anchors can be recovered from the insoluble pellet/fraction after membranes have been treated with Triton® X-114 (X114). Enzymatic release of the GPI anchor from the cell membrane may trigger second messengers for signal transduction.
Functions
GPI-anchored proteins have been involved in membrane protein transportation, cell adhesion, cell wall synthesis, and cell surface protection. In yeast, GPI-anchored proteins are components of the cell wall and are necessary for cellular integrity. Some GPI anchored proteins are antigens, such as human carcinoembryonic antigen (CEA), which is used as a cancer marker. Others such as human reversion-inducing cysteine-rich protein with Kazal motifs (RECK) inhibit tumor invasion and metastasis. In mammalian cells, GPI-anchored proteins are concentrated in lipid rafts that are involved in receptor-mediated signal transduction pathways and membrane trafficking. The GPI anchor regulates secretion of cryptococcal phospholipase B and is necessary for prostatin to regulate transepithelial resistance and paracellular permeability.
Materials
Reference
To continue reading please sign in or create an account.
Don't Have An Account?