鱼油胶囊和养殖鲑鱼中ω-3脂肪酸的气相色谱分析
ω-3脂肪酸的摄取对健康的益处是多方面的1。在人体生理学中最重要的变异体似乎是:
- C18:3n3,α-亚麻酸 (ALA)
- C20:5n3, 二十碳五烯酸 (EPA)
- C22:6n3, 二十二碳六烯酸 (DHA)
本文旨在鉴定两种不同来源鱼油中的ω-3脂肪酸。每种来源都只处理了单个样本,因此本文中这些不同来源之间的谱图比较不可视为定论。
实验
本文分析的样品如下:
- 当地购买的鱼油胶囊,标明含有 EPA、DHA 和“其他”ω-3。
- 大西洋鲑鱼片(农场养殖),冷冻和真空包装。
如 AOAC 方法 991.392中所述,制备鱼油胶囊以依次进行碱水解和甲基化的分析。在整个提取过程中用氮气覆盖混合物以防止多不饱和脂肪酸的氧化。鲑鱼样品依照AOCS官方方法 Ce 1k-093进行酸消化、碱水解和甲基化。在提取之前,将二丁基羟基甲苯(BHT)作为抗氧化剂添加到鲑鱼样品中。分析前,两种方法都使用甲基化操作程序将脂肪酸转化为脂肪酸甲酯 (FAME)。在进行气相色谱(GC)分析之前,将所有提取物浓缩至1 mL。
使用两种选择性略有不同的毛细管气相色谱柱进行分析,条件依照 AOAC 991.39 和 AOCS Ce 1i-07 方法2,4。这是可行的,因为两种方法共享相同的一组运行条件。将保留时间与标准进行比对以鉴定谱峰,数据已在之前发布5。
结果和讨论
鱼油胶囊包装上标明的鱼源有沙丁鱼和凤尾鱼。根据这些鱼油公开的脂肪酸组成数据,预计FAME中含量最丰富的是C16:0和C20:5n3 (EPA),其次是C16:1、C18:1和C22:6n3(DHA)6。鱼油胶囊提取物的色谱图见 图1,符合预期模式。检测到的C14:0谱峰来自鱼油的沙丁鱼部分,这种脂肪酸在凤尾鱼油中的含量要低得多。
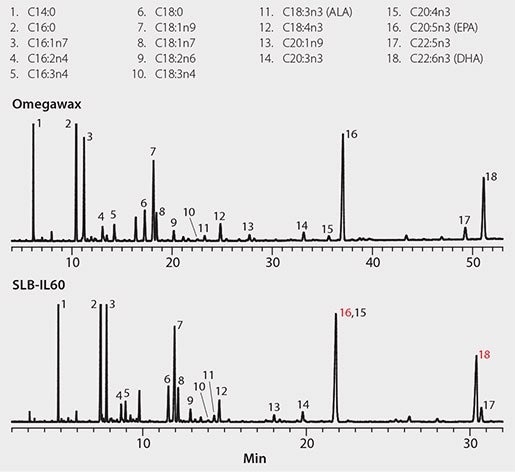
图 1.鱼油胶囊
GC条件
- 色谱柱:Omegawax®,30 m x 0.25 mm 内径,0.25 µm(产品编号24136) SLB®- IL60,30 m x 0.25 mm 内径,0.20 µm(产品编号29505-U);
- 温箱:170 °C, 1 °C/min to 225 °C;
- 进样温度:250 °C;
- 检测器:FID,260 °C;载气:氦气,1.2 mL/min;
- 进样体积:1 µL,100:1 分流;
- 衬管:4 mm 内径,分流/不分流型,羊毛填充单锥形FocusLiner™设计
图2显示了农场养殖大西洋鲑的色谱图。公开的鲑鱼油脂肪酸组成表明C22:6n3(DHA)、C18:1和C20:5n3 (EPA)是最丰富的,其次是 C16:0、C16:1、C18:0、C20:1和 C22:1[6]。虽然检测到了所有列出的脂肪酸,但样品获得的谱图与此模式不符。具体来说,相对于C22:6n3(DHA)和C20:5n3(EPA),C22:6n3(DHA)和C20:5n3(EPA)的水平更高 ,这可能是鱼被投喂特定食物的结果。
这些分析物用两种色谱柱均观察到良好的峰形。由于两种色谱柱具有相似的选择性,洗脱顺序相当,但并不完全相同。使用 SLB-IL60:
- 观察到C22:6n3 (DHA)在C22:5n3 之前洗脱
- C20:4n3和C20:5n3 (EPA)发生部分共洗脱
这些突出体现了不同色谱柱之间的分析物-固定相机理的差异。最后,用SLB-IL60获得整体更快的洗脱(31 min对比52 min)。
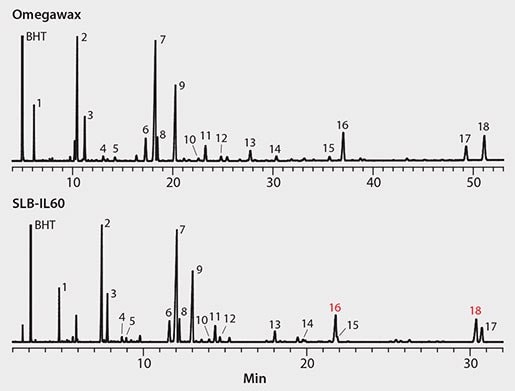
图 2.农场养殖大西洋鲑
GC条件
谱峰ID和条件与 图1相同
结论
本文提供的数据表明两种不同来源的鱼油中可能存在不同的ω-3脂肪酸。每种来源都只处理了单个样本,因此本文中这些不同来源之间的谱图比较不可视为定论。两个选择性略有不同的GC色谱柱用于生成具有细微洗脱顺序变化的色谱图,为希望进行验证性分析的分析人员指明了这些阶段。
材料
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?