疫苗和药物开发用mRNA合成
- mRNA 疫苗如何诱导免疫
- mRNA 作为疫苗药物的优点
- mRNA 合成所需的质粒 DNA (pDNA) 制备
- mRNA 体外转录和加帽
- 体外转录 (IVT) mRNA 合成试剂
- mRNA纯化和分析
- mRNA 合成过程中的dsRNA去除
- 合成 mRNA 纯化和分析试剂
合成 mRNA 有可能重现成熟 mRNA 功能,有望应用于一系列生物制药应用。这类治疗应用包括体内递送 mRNA 进行蛋白质替代、干细胞诱导或癌症免疫治疗。最近的重要制药应用包括针对传染病的新疫苗途径——尤其是针对 SARS-CoV-2 的 mRNA 疫苗。
如需完整的 mRNA 疫苗产品和解决方案,请访问我们的疫苗开发和生产页面。
mRNA 疫苗如何诱导免疫
使 RNA (mRNA) 疫苗基于 mRNA 编码蛋白质的中心法则。这种直接的疫苗途径以编码全部或部分抗原蛋白的遗传元件作为可翻译分子,诱导免疫反应。 编码靶标抗原的 mRNA 被抗原递送细胞摄入并翻译成靶标病原体蛋白,进而诱导免疫反应。此方法可精密模仿病毒感染细胞的自然过程。
mRNA 作为疫苗途径的优势
通常,mRNA疫苗通过酶促过程在体外合成生产。相对于更传统的途径,mRNA 疫苗开发和制造过程相对简单,且可在短时间内完成。这一性质使其适合加速开发和放大生产,迄今经证对于紧急公共卫生事件至关重要。创新的 mRNA 疫苗设计和制剂可增强热稳定性,使疫苗无需冷链配送,从而降低生产成本并提高全球覆盖范围。
mRNA 合成的质粒 DNA(pDNA) 制备
对于 mRNA 疫苗设计,通常通过体外转录质粒 DNA (pDNA) 模板制备功能性合成 mRNA。质粒载体通常包含以下元件:T7、SP6或T3 RNA聚合酶(均源自噬菌体)特异性识别的上游启动子; 5' UTR、cDNA、3' UTR、下游poly A尾; 以及poly A尾下游的独特切割位点。
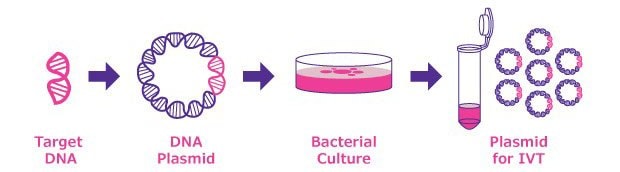
图 1.体外转录(IVT)质粒制备。基因合成后,使用质粒载体 (pDNA) 克隆目标 DNA。pDNA 在细菌培养物中扩增,然后通过核酸纯化方法(例如离心柱搭配硅胶模膜)进行纯化。
mRNA 体外 转录和加帽
噬菌体 RNA 聚合酶常用于转录线性化质粒 DNA。首先用指定的独特限制位点切割酶将 pDNA 线性化。酶解后,可通过苯酚-氯仿方案或GenErude PCR纯化试剂盒等方法纯化线性化的 pDNA。如需进行大规模纯化,通常建议使用切向流过滤(TFF),因为此过滤技术支持轻松放大。线性化后,在含有重组RNA聚合酶(T7、T3 或 SP6)和三磷酸核苷以及帽类似物(如 CleanCap®试剂或 ARCA(抗反向帽类似物))的混合溶液中进行体外转录和加帽。N1-甲基伪尿苷-5'-三磷酸(N1-甲基伪尿苷、1-甲基伪尿苷)等修饰核苷可代替GTP抑制先天免疫系统,用于现有mRNA疫苗。 由于与GTP竞争,ARCA对mRNA的平均加帽效率为70~80%——与标准mRNA合成相比,mRNA产量减少了约四分之一。 而CleanCap®试剂表现出 94% 的加帽效率,且不影响 mRNA 产量。也可在无帽类似物的情况下转录加帽,此时需要转用痘苗病毒编码的加帽复合物(加帽酶、2'-O-甲基转移酶、GTP 和 S-腺苷甲硫氨酸 (SAM))。加帽效率因目标 mRNA 的二级结构而异。最后,当模板pDNA的poly A尾长度不足(最多150个碱基)时,可使用poly A酶进行延伸。
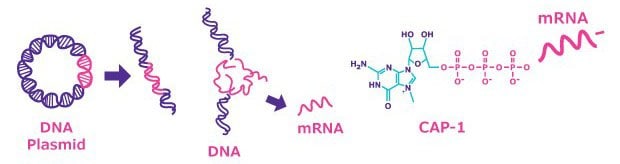
图 2.mRNA合成通过pDNA线性化、无细胞方法mRNA的体外转录,以及利用帽类似物或病毒编码加帽复合物进行的mRNA加帽实现。
体外转录 (IVT) mRNA 合成试剂
mRNA纯化和分析
mRNA 纯化第一步是使用脱氧核糖核酸酶或 DNase 去除线性化的 pDNA 模板。然后用氯化锂(LiCl)沉淀 mRNA,并用 75% 乙醇洗涤。所得 mRNA 沉淀可用水或重悬缓冲液复溶。但在放大生产过程中应避免使用这类沉淀方法,因为这种方法有些难以放大,且 GMP 生产规范要求避免使用有害溶剂。建议使用GenElute™ mRNA Miniprep Kit纯化试剂盒进行小规模纯化。如需扩大规模,可以使用Pellicon®超滤盒进行切向流过滤 (TFF),此方式支持线性放大。
mRNA合成过程中的dsRNA去除
双链 RNA (dsRNA)是一种转录副产物,是 mRNA 合成的主要伴随产物。dsRNA 可刺激先天免疫反应,减少递送的 mRNA 翻译。因此,利用合成 mRNA 开发疫苗时,应去除 dsRNA。可利用基于纤维素纤维的纤维素滤纯化方法去除各种规模的 dsRNA。
合成mRNA纯化和分析试剂
如要继续阅读,请登录或创建帐户。
暂无帐户?