N-Nitrosamines Determination in Valsartan
A GC-MS Method for Pharma Quality Control According to US FDA Guide Lines
In July 2018, regulatory authorities for medicines were informed about the occurrence of a nitrosamine impurity (N-nitrosodimethylamine, NDMA, Figure 1) in valsartan-based products.1 The active pharmaceutical ingredient (API) valsartan is an angiotensin-Il- receptor blocker. It is used to treat hypertension, heart failure, and heart attack in patients intolerant to ACE inhibitor therapy.2 Valsartan belongs to a group of structurally related compounds known as sartans, having a tetrazole group (a ring with four nitrogen and one carbon) in common. Later, other nitrosamine impurities such as N-nitrosodiethylamine (NDEA), N-nitrosodiisopropylamine (NDIPA), N-nitrosoethylisopropylamine (NEIPA), and N-nitrosodibutylamine (NDBA) were found to be present in other medicines belonging to the sartan family, and in ranitidine drugs. The subsequent issue of worldwide recall on pharmaceutical products using bulk valsartan drug substances lead to an interim shortage of valsartan-based drugs in the market.
N-nitrosamines contain the nitroso functional group (-N=O). According to the International Agency for Research on Cancer (IARC) from the World Health Organization (WHO), most of the nitrosamines are carcinogenic and genotoxic to animals and probable carcinogens to humans. The authorities and API manufacturers discovered the formation of nitrosamines in the reaction of secondary or tertiary amines and nitrites under acidic conditions during the manufacturing process. Sartans require sodium nitrite for the formation of a tetrazole ring which can then result in the formation of N-nitrosamines. Or the nitrosamines might be added with contaminated solvents, reagents, or manufacturing equipment.3 This led the European Pharmacopoeia (Ph. Eur.) Commission to set up an interim limit of less than 1 ppm for nitrosamines in APIs, and the limit was reduced to 30 ppb at end of 2020.4
The measurement at these limits requires the use of highly sensitive and highly selective analytical techniques. Most methods either use GC-MS or HPLC-MS.5-7 Another challenge to their analysis is the variety of nitrosamines, APIs, and formulations, which necessitate specifically tailored methods for impurity testing.
This work presents a procedure for the determination of 5 nitrosamine impurities (NDMA, NDEA, NEIPA, NDIPA, and NDBA) in a valsartan drug product at trace levels by GC-MS/MS in EI MRM mode, according to US FDA guidelines. One of the FDA’s Office of Testing and Research (OTR) published methods was used as base for method development.8 Method validation was conducted according to the requirements of USP.9
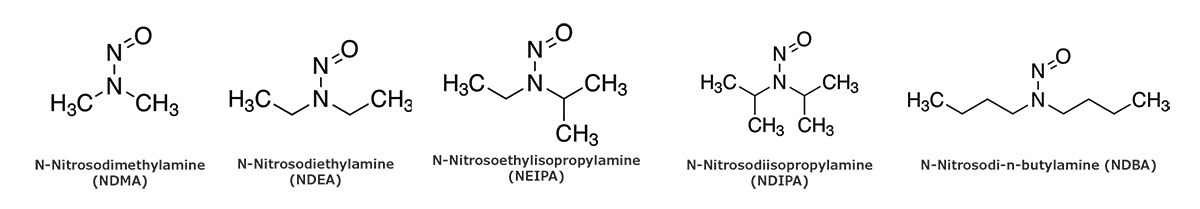
Figure 1.Molecular structure of the N-nitrosamines investigated in this study
Experimental
The GC-MS/MS method used liquid injection to cover a broad range of nitrosamines. Contrary to the OTR method, a wax column with a thinner film thickness (0.5 µm instead of 1 µm) was chosen. But this complied with the USP general chapter <621> on chromatography.10 The chromatographic conditions, as well as the MS/MS conditions are shown in Tables 1 to 3.
The five nitrosamines were sufficiently separated in less than ten minutes and the target peaks were well resolved from the solvent and matrix peaks (Figure 2). The observed retention times which were shorter compared to the FDA OTR method, could be attributed to the lower film thickness of the GC column.
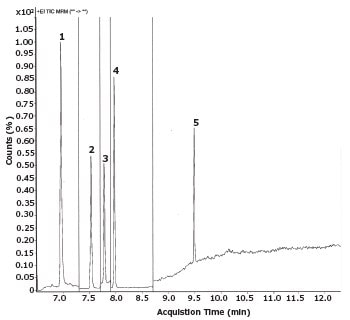
Figure 2.Exemplary chromatogram of the system suitability solution with a concentration of 40 ng/mL. For peak labeling please see Table 3.
Low limits of detection were achieved by multiple reaction monitoring (MRM) for two transitions. Two examples are shown in Figure 3 by the chromatograms of NDEA and NDIPA at the lowest concentration of 2.5 ppb with a signal to noise ratio of more than 10.
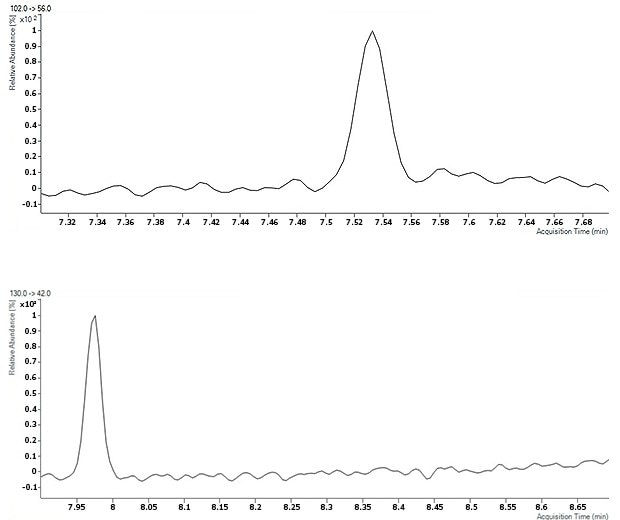
Figure 3.Chromatograms of NDEA (top) and NDIPA (bottom) at the lowest concentration of 2.5 ppb.
Method Suitability
The validated FDA-OTR method requires the % RSD for six replicate injections of a 40 ng/mL standard to be ≤ 5%. Using our method, the % RSD for six consecutive injections of the 40 ng/mL standard was less than 5% for all the impurities at both MRMs, as shown in Table 4.
Furthermore, the correlation coefficient (r2) of the linear calibration curves should be ≥0.998. Our method exceeded this for all five nitrosamines at both MRMs (Table 5).
Application on Valsartan Drug Product
A commercial valsartan product purchased at a local pharmacy was spiked with nitrosamine impurities to a concentration of 10 ppb (40 ppb for NDBA) in the drug product. The recovery rates of the nitrosamines were measured and found in the range of 94.5 to 105.7% respectively (Table 6).
The FDA-OTR method reported the limits of quantification (LOQs) for the determination of the nitrosamines in valsartan products to be in the range of 8 – 40 ppb. Our method achieved even lower LOQs in a valsartan drug product (Table 7). The LOQs were calculated from the calibration curves based on a signal/noise (S/N) ratio of 10 for each of the compounds and validated by standard addition experiments to valsartan tablets. Limits of detections (LOD) were calculated using a signal/ noise (S/N) ratio of 3.
Summary
The determination of nitrosamine impurities can be easily achieved by GC-MS/MS in MRM mode using the SUPELCOWAX® column based on the suggested method by FDA-OTR. All nitrosamines were well separated from each other as well as from the solvent and matrix peaks, meeting the system suitability requirements. The method was successfully applied for the analysis of a valsartan drug product spiked with nitrosamine impurities.
Materials
GC Column
Solvents
Reference Materials
Accessories
References
To continue reading please sign in or create an account.
Don't Have An Account?