引物浓度优化实验方案
qPCR条件优化
QPCR 条件的优化对于制定稳健的检测方案非常重要。优化不佳的表现是重复样本之间缺乏再现性,以及检测低效且不灵敏。两种主要优化方法是优化引物浓度和/或退火温度。
优化引物浓度的一种方法是建立一个反应阵列。该阵列用来对照伴侣引物的不同浓度来测试每种引物的一系列浓度。本实验方案给出的示例是用一个6×6阵列测试六种浓度(例如50 nM至800 nM)。本实验方案所述的数量都允许每个条件一式两份运行。
引物浓度优化实验方案中使用的设备
- 定量PCR仪器
- PCR设置的层流罩(选购件)
试剂
- 合适的测定模板,例如1:10稀释的cDNA、gDNA或合成的寡核苷酸模板。
- KiCqStart® SYBR® Green ReadyMix™(KCQS00/KCQS01/KCQS02/KCQS03—取决于仪器,有关仪器兼容性,请参见表 P4-6)。
- PCR级水:PCR级水(W1754或W4502),20mL等分试样;冻存;每次反应均使用新鲜的等分试样。
- 正向和反向引物浓缩原液(10 μM工作原液)。
• 可以在sigmaaldrich.com/oligos上订购定制寡核苷酸。
耗材
- 无菌过滤器移液管吸头
- 无菌 1.5 mL 螺旋盖微量离心管 (CLS430909)
- PCR管和PCR板,选择一种以匹配所需格式:
• 单个独立的薄壁200μLPCR管(Z374873或P3114)
• 孔板
- 96孔板(Z374903)
- 384孔板(Z374911)
• 孔板密封
- ThermalSeal RTS™ 封膜 (Z734438)
- ThermalSeal RT2RR™ 封膜 (Z722553)
本方案注意事项
- 使用随机引物或oligo-dT引发方法产生cDNA,并以1:10稀释备用,但也可以使用任何合适的替代模板。
- 根据板的布局,所有样品一式两份运行(图P13-18)。
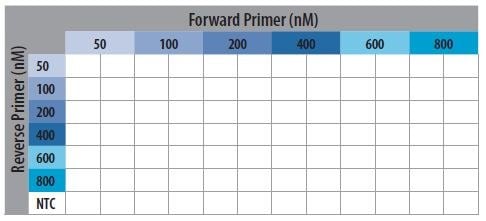
图 P13-18.引物优化板布局示意图。
方法
注意:将2.0 μL的每种引物加入到总体积为20 μL的反应物中。为此,需要10倍所需浓度原液才能达到所需的最终浓度。
1. 使用10 μM引物原液,将两种引物原液稀释至0.5、1、2、4、6和8 μM,
如表P13-32所示。
2. 按照表 P13-33制备qPCR预混液。
(注意:步骤5中的模板和cDNA应分开加入)。充分混合。
*注意:在步骤5之前不要添加cDNA和引物。
3. 将步骤2中的184.8 μL预混合物(对12× NTC)移入单独的管中,用来设置
无模板对照(NTC)反应。
4. 将26.4 μL的dH2O添加到步骤3中的NTC混合物中(以替换模板)。
注意:将NTC混合物置于冰上以备后用。
5. 将158.4 μL cDNA模板添加到步骤2中剩余的预混液中。将预混液置于冰上。
6. 根据图 P13-18,将2.0 μL适当的反向引物稀释液添加至PCR板中,再将
800 nM浓度溶液添加到NTC行。
7. 根据图 P13-18,将2.0 μL适当的正向引物稀释液添加至PCR板中。
8. 将步骤5中的16 μL预混液等分到PCR板上对应测试反应位置的孔中。
9. 将步骤4中的16 μL 预混液等分到PCR板NTC反应孔中。
10. 封板并贴好标签。(确保标签不会遮挡仪器的激发/检测光路。)
11. 根据表 P13-34的两步实验方案运行样品。重复执行第1-2步40次,然后进行解离曲线分析。
说明:使用标准解离曲线实验方案(数据收集)。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?