PURedit™ Cas9 – 一种高度特异性且高效的基因组编辑RNP系统
- SpCas9为什么被广泛使用?
- CRISPR基因编辑PURedit™ Cas9 RNP系统的开发
- 我们Cas9蛋白变体的改造方法
- 对一种可产生优化性能特征的三重突变体Cas9蛋白的鉴定
- PURedit™ CRISPR Cas9 RNP系统和相关试剂
SpCas9为什么被广泛使用?
酿脓链球菌 CRISPR-Cas9(SpCas9)灵活且成本较低,常用作包括植物和人类等多个物种的主要基因组编辑工具。天然的SpCas9可耐受引导RNA序列和靶DNA序列之间的错配;然而,这常常会导致脱靶效应。为了克服这一缺点,几个小组已经通过基于结构的合理设计或定向进化开发出了各种具有更高特异性的SpCas9变体。然而,由于这些特异性增强的变体是在质粒过表达条件下选择的,当它们作为一种纯化的重组蛋白被递送并与体外转录或化学合成的引导RNA在预组装核糖核蛋白(RNP)复合物中进行结合时,它们的编辑效率通常会显著降低。在这里,我们对由我们高保真Cas9 Plus蛋白和我们PEXBUFF转染增强子组成的PURedit™ RNP系统的开发和性能进行了介绍。
CRISPR基因编辑PURedit™ Cas9 RNP系统的开发
为了维持特异性和活性,我们探索了不同的蛋白改造策略。该策略包括对可能参与到不同靶标DNA相互作用或Cas9核酸酶激活模式的关键残基进行鉴定和突变,以及对其性能进行评估。我们使用纯化的重组蛋白复合合成单链引导RNA(sgRNA)在人类细胞中对这些变体进行筛选。通过在一组靶位点和脱靶位点上对蛋白变体进行分层,我们鉴定出了几种兼具平衡的特异性和有利的单突变的蛋白变体。随后对这些变体进行组合试验,从而鉴定出同时具有优化的上靶和脱靶活性的突变。与此同时,我们也筛选了几种可提高Cas9 RNP复合物编辑效率的化合物,并鉴定出了一种能够提高这些高特异性变体在难以编辑的基因组位点上编辑效率的RNP增强子。因此,通过将其中一种高特异性的变体与RNP增强子相结合,我们开发出了适用于需要对Cas9 RNP复合物进行递送的基因组编辑应用的PURedit™ Cas9 RNP系统。

图 1.纯化的Cas9蛋白上靶和脱靶活性的评估方法。携带靶向突变的Cas9变体通过自诱导在大肠杆菌BL21AI中表达,并通过Ni-NTA亲和层析进行了纯化。通过RNP复合物递送,用合成sgRNA对纯化的Cas9蛋白在人类K562细胞中的上靶和脱靶活性进行了评估。通过多轮蛋白改造来鉴定具有平衡的活性和特异性的变体。

图 2.改造后Cas9重组蛋白变体的活性和特异性。一组改造后Cas9蛋白变体在K562细胞中靶向人类β-珠蛋白基因(HBB)靶点和单错配脱靶点的活性。一些变体表现出了高活性和高特异性,而一些变体则几乎丢失了全部活性。
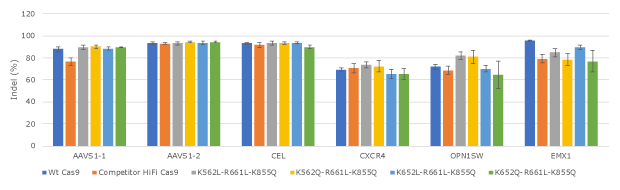
图 3.在人类K562细胞中对领先的Cas9蛋白变体针对更多位点组合的编辑效率进行评估。所有的Cas9蛋白都通过电穿孔在人类K562细胞中进行了三重复检测。
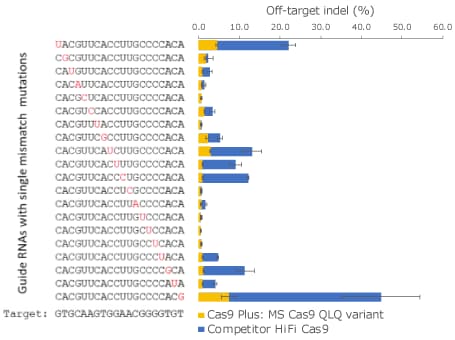
图 4.K652Q-R661L-K855Q变体与竞品HiFi Cas9间的特异性比较。两种Cas9蛋白都在人类K562细胞中用20种合成sgRNA进行了三重复检测,如图2所示,每种对同一人类HBB靶位点都具有一个位于不同位置的单错配。
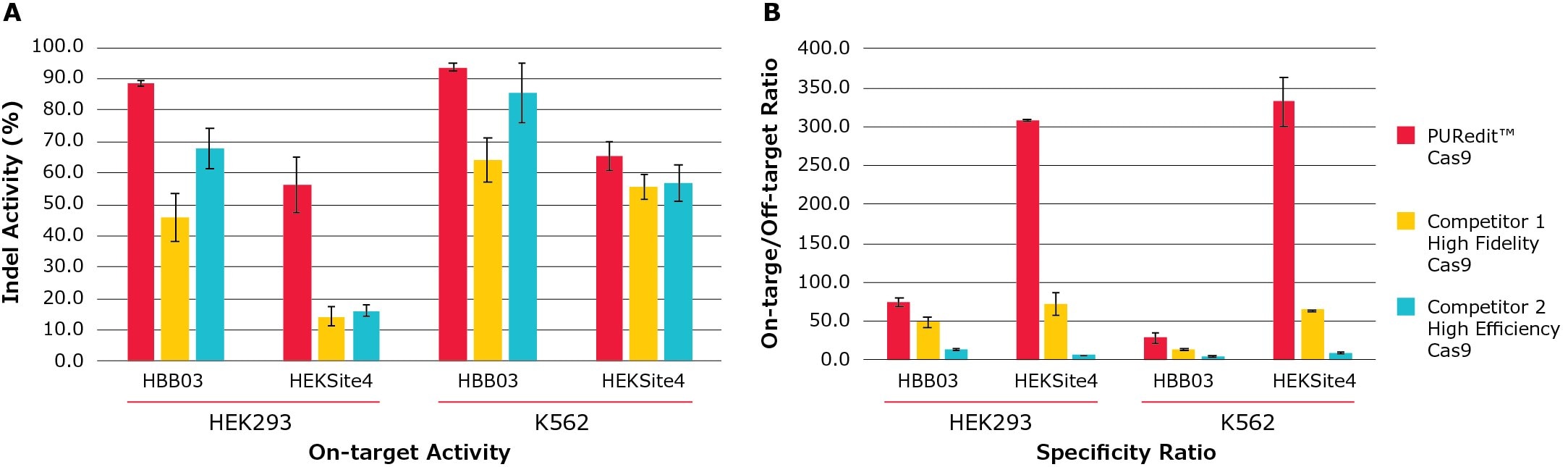
图 5.PURedit™ CRISPR RNP与竞品的上靶活性和特异性比例比较。用PURedit™ sgRNA分别和PURedit™ Cas9、高保真变体Cas9竞品1和高效率Cas9竞品2进行了复合,并通过电穿孔进入到HEK293和K562细胞中。每种Cas9变体都搭配了靶向两个不同基因的两段不同PURedit™ sgRNA。每次转染都包含5 µg的Cas9蛋白和100 pmol的PURedit™ sgRNA。(A) 通过二代测序(NGS)对两段sgRNA在其靶点的插入和缺失平均比例(Indel活性%)进行了测定。PURedit™ RNP复合物在两种细胞系中的两个靶点上都表现了比竞品更高的切割效率。(B) 通过在活性最高的脱靶点上对插入和缺失进行定量而对来自(A)的转染后细胞进行了特异性分析,并对上靶和脱靶活性的比例进行了计算。PURedit™ Cas9在所有靶点上都表现出了最高的比例,证实了对所有预期靶点都具有较高的特异性和活性。
PURedit™ CRISPR Cas9 RNP系统和相关试剂
我们开发了一组高特异性的SpCas9蛋白变体,它们通过多模式蛋白改造和RNP复合物递送而保持了高水平的活性。我们还鉴定出了一种Cas9 RNP电穿孔增强子,用于提高Cas9 RNP的编辑效率,特别是在难以编辑的基因组位点上。通过将其中一种高特异性变体与RNP增强子结合,我们开发出了PUReditTM RNP系统,与其他商业高保真或高效率Cas9蛋白产品相比,它能够实现有效的基因组编辑并显著降低脱靶效应(图5)。
如需更多资源,请探索我们的预设计CRISPR gRNAs、设计定制gRNA或选择最适合您需求的定制gRNA。如有更多问题,请与我们的专家进行联系。
相关材料
如要继续阅读,请登录或创建帐户。
暂无帐户?