BINOL及其衍生物
BINOL及其衍生物是在不对称合成中最广泛使用的配体类型之一;被用于各种反应,其中包括:Diels–Alder、羰基的加成和还原、Michael加成以及多种其他反应。尽管利用BINOL催化体系已获得了巨大的成功,但其他C2-对称二醇配体也引起了一定的关注。这其中包括由Wulff及其同事开发的拱形联芳基配体。拱形的3,3'-联苯酚(VAPOL)和拱形的2,2'-联萘酚(VANOL)都被证明是催化不对称Diels-Alder、亚胺醛和氮杂环丙烷化反应的优秀配体(图1)1。最近,VAPOL的磷酸衍生物被证明是一种有效的手性Brønsted酸催化剂。在这里所示的许多实例中,拱形联芳基比使用BINOL配体在相同的反应中具有更高的产率和诱导率。
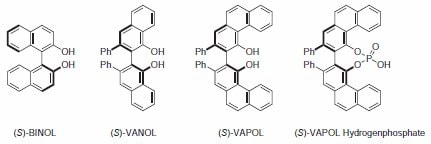
图 1.
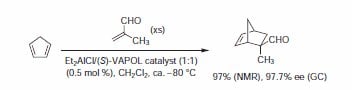
方案 1.
不对称氮杂环丙烷化反应
氮杂环丙烷是有机合成中的重要组成部分,因为它们可以实现胺、氨基醇、二胺和其他有用含氮分子的便捷获取。现在的许多手性氮杂环丙烷的制备方法都依赖于手性池。最近,Wulff小组已经开发出一种稳健的催化型不对称氮杂环丙烷化反应,可提供高产率和选择性的光学活性氮杂环丙烷。该反应依赖于在由拱形芳基配体和B(OPh)3制备的芳基硼酸酯催化剂存在下,将可购买到的重氮乙酸乙酯(EDA)添加到二苯甲基亚胺上。3该氮杂环丙烷化反应对顺式异构体显示出了极好的选择性,并获得了较高的ee值。所生成的苯甲酰基保护的氮杂环丙烷经历了各种反应,包括:去保护、还原性开环或烷基化反应(方案2,表1)。白细胞整合素LFA-1拮抗剂BIRT-377的不对称合成利用的是一种叠氮/烷基化方法,可以极佳的总产率提供乙内酰脲靶标。
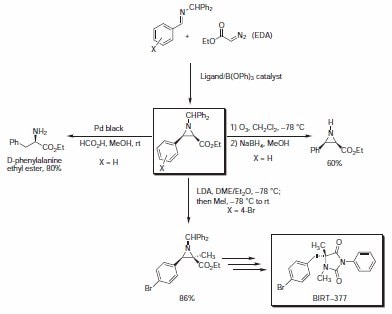
方案 2.
抗菌剂(-)-氯霉素的快速合成利用的是不对称的叠氮化反应,以及随后氮杂环丙烷与二氯乙酸的亲核开环和后续的酰基迁移(方案3,表2)。VANOL和VAPOL比BINOL衍生的催化剂均能得到更高的产率和立体选择性。
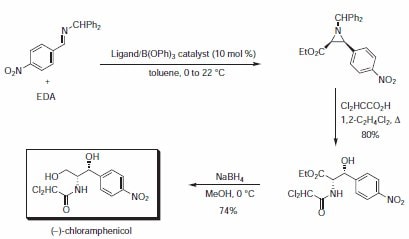
方案 3.

方案 4.

方案 5.
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?