裂解酶
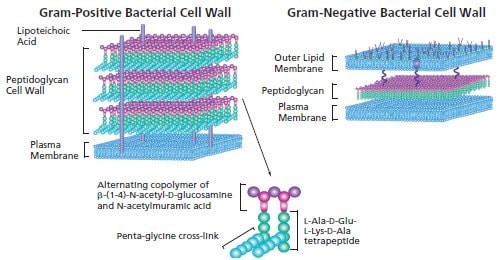
图 1.革兰氏阳性细菌细胞壁和革兰氏阴性细菌细胞壁
革兰氏阳性细菌的细胞壁是由多层肽聚糖组成。肽聚糖是由 β-(1-4)-N-乙酰-D-葡萄胺单体形成的聚合物。替代残基被修饰形成N-乙酰胞壁酸,加入乳酸形成侧链连接到四肽。相邻聚合物的四肽再由5-甘氨酸肽桥相连。交错相连的肽聚糖聚合物形成网格状网络覆盖在磷脂双分子层的细胞膜外。
革兰氏阳性细菌细胞壁是由一层外双层脂构成,除了含有磷脂外,同样覆盖有脂多糖。在周质空间中,膜蛋白将外层脂膜连接到薄肽聚糖层。内层的细胞膜是磷脂双分子层。
哪些酶能完成您的工作 - 裂解酶
Labiase
货号L1414(粉末) 来源于极暗黄链霉菌Streptomyces fulvissimus
- 来源于极暗黄链霉菌(Streptomyces fulvissimus)的Labiase裂解酶适于裂解许多革兰氏阳性细菌,如乳酸菌、气球菌和链球菌。
- Labiase 具有N-乙酰-β-氨基葡萄糖苷酶和溶菌酶活性。
- 活性最适PH值范围:pH ~ 4
- 稳定性最适PH值范围:pH ~ 4-8
溶葡球菌酶
货号L7386 (冻干粉,最低500 units/mg蛋白质)
货号L4402(冻干粉, 最低2,000 units/mg蛋白质, >97% SDS-PAGE)
货号L2898 (无菌装,冻干粉,最低500 units/mg 蛋白质)
货号L9043(冻干粉,最低3000 unit/mg 固体蛋白)
- 溶葡球菌酶是锌内肽酶,分子量约25 kDa。溶葡球菌酶能切开葡萄球菌属细胞壁肽聚糖层的多聚甘氨酸交联键,既可用于细胞裂解也能作为潜在的抗菌治疗物。
- 活性最适PH值范围:pH ~ 7.5
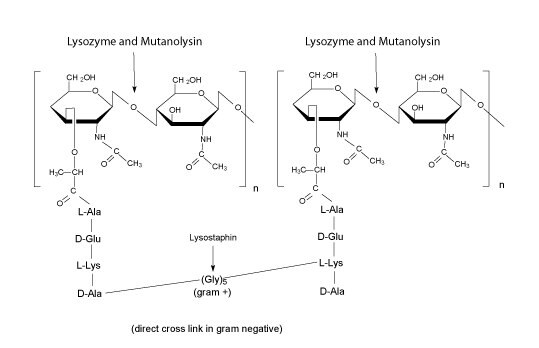
图 2.溶菌酶和变溶菌素
鸡蛋清来源溶菌酶
货号L6876 (透析,冻干,约 50,000 un/mg)
货号L7651(分子生物级,冻干,约50,000 un/mg)
货号L/CN/zh7001(冻干,约 50,000 un/mg)
货号 L7773 (无菌装,冻干,约 50,000 un/mg)
货号L2879(氯化钠,冻干,约 60,000 un/mg)
人源溶菌酶
货号L1667(大米中表达重组体)
货号L6394(来源于人奶)
货号L8402(来源于人中性粒细胞)
- 溶菌酶是分子量14.3 kD的单链蛋白。它能水解肽聚糖中N-乙酰葡糖胺酸和N-乙酰-D-葡萄胺残基间的 β(1-4)键,也能水解壳糊精中的N-乙酰-D-葡萄胺残基连接键。革兰氏阳性菌细胞壁肽聚糖含量很高,对此类水解作用非常敏感。而革兰氏阴性菌有外膜且细胞壁肽聚糖含量低,所以对此类水解没有这么敏感。存在EDTA时,这些细胞裂解会更容易发生,因为EDTA会鳌合外层细菌细胞膜的金属离子。
- 最适pH:溶菌酶的活性取决于pH值和离子强度的共同作用。溶菌酶的活性pH范围非常广(6.0- 9.0)。与pH 9.2 时(0.01 - 0.06 M)相比,pH 6.2时观察到活性最大的离子浓度范围(0.02 - 0.100 M)更广。
- 在裂解过程中,使用新鲜制备的500,000 units/ml 10 mM Tris-HCl(pH 8.0)溶液。该产品可溶于水(10 mg/ml),形成澄清或者稍浑浊的无色溶液。水溶液2–8 °C冷藏可稳定保存至少一个月。25 µl储液能裂解>1ml复溶于350 µl 10 mM Tris-HCl(pH 8.0)、加入 0.1 M NaCl、1 mM EDTA和 5% [w/v] TRITON. X-100的大肠杆菌培养基细胞团。一般裂解孵育条件是 37 °C、30min。
消色肽酶
货号A3422(部分纯化粉末,20,000-40,000 units/mg固体)
货号 A3547 (粗粉,800-3,200 units/mg固体)
货号A7550 (粗粉,300-600 units/mg固体)
- 消色肽酶是分子量约为27kD的赖氨酰肽链内切酶,可用于裂解耐受溶菌酶的革兰氏阳性菌。
- 活性最适pH范围:pH ~ 8.5 - 9
- 在37 °C下,约500-1,500 un/ml 消色肽酶可在2个多小时内裂解A600=0.6浓度的细胞。
球孢链霉菌(Streptomyces globisporus)源变溶菌素
货号SAE0092 (冻干, min 4000un/mg 蛋白)
货号M9901 (冻干, min 4000un/mg 蛋白)
货号M4782 (无菌装,冻干,min 4000un/mg蛋白)
- 变溶菌素裂解温和,适于分离细菌来源的易降解生物分子和RNA,已用于形成DNA分离的原生质球。
- 变溶菌素是分子量23kD的N-乙酰胞壁质酶。变溶菌素和溶菌酶一样,是一种胞壁质水解酶,可切断细菌细胞壁肽聚多聚糖聚合物的N-乙酰胞壁酰-β(1-4)-N-乙酰氨基葡萄糖键。它的羧基末端部分参与特殊细胞壁聚合物的识别和结合。变溶菌素可裂解李斯特菌和其他一些革兰氏阳性菌,如乳酸菌和乳球菌。
金黄色葡萄球菌(Staphylococcus aureus)源α-溶血素
货号 H9395
- α-溶血素是一种细胞外蛋白,大多数致病金黄色葡萄球菌都会分泌。
- 成熟的蛋白体包含有293个分子量为33kD的残基。它含有65% β折叠和10% 的α螺旋结构。
- α-溶血素作为水溶性单体分泌,首先结合并掺入目标细胞膜。单体组装形成一个七聚体孔,能允许 K+ 快速流出、Na+和Ca+快速流入。红细胞的渗透膨胀最终导致细胞破裂。
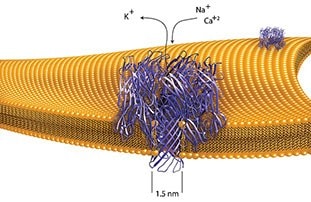
图 3.金黄色葡萄球菌
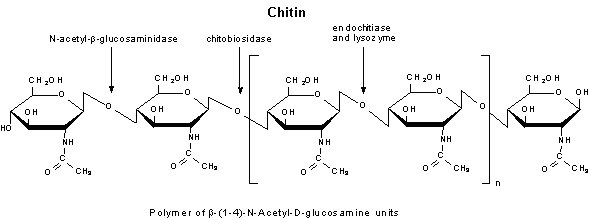
图 4.几丁质酶
- 几丁质酶是分子量约为 30 kDa的胞外酶聚体,能够降解几丁质。
- 几丁质通过2步酶促反应,降解为N-乙酰-D-葡糖胺。首先,几丁质酶(一种聚(1,4-β-[2-乙酰氨-2-脱氧-D-糖苷])-溶菌酶)去除几丁质的壳二糖。然后N-乙酰氨基葡萄糖苷酶切断双糖和N-乙酰-D-葡糖胺单体亚基。
- 该酶可以分为内切几丁质酶和外切几丁质酶。内切几丁质酶活性作用包括随机剪切极少的几丁质链内部位点。外切几丁质酶活性作用包括从几丁质非还原性端开始剪切和释放壳二糖或者N-乙酰-葡糖胺单体亚基。
微生物组 - 测序和系统发育
近年来,随着16S rRNA 基因测序和宏基因组学等技术的广泛应用,微生物群落研究取得了革新性进展。这种基于序列的技术方法的主要挑战是在微生物样品制备过程中可能出现DNA污染,因此必须采用不含DNA污染物的DNA提取试剂。
处理微生物组学样本的另一个主要挑战在于微生物很难被破坏,因为处理后细胞壁可能会形成荚膜或抗性孢子。通过使用细胞溶解酶诱导形成部分原生质球,可以从微生物中提取DNA。这些原生质球随后可被裂解以释放DNA。
用于微生物组研究的无DNA细胞裂解酶
我们提供日益丰富的无微生物 DNA 裂解酶和酶混合物,既可帮助改善微生物组样本裂解,又不会产生随机 DNA 污染。
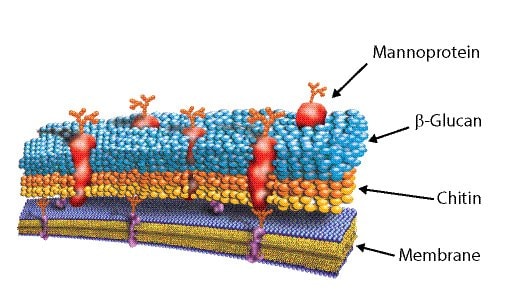
图 4.酵母细胞壁
在酵母中,细胞壁占了细胞干重的约30%。酵母细胞壁由约20%的螺旋 β(1-3) 和β(1-6)-D-葡聚糖,约25%的寡甘露聚糖,约20%的蛋白质,约10%的脂类和一些几丁质组成。蛋白质组份以甘露糖蛋白复合物为主。在几丁质还原性端和 b(1-3)葡聚糖非还原性端,糖蛋白、β(1-6)-葡聚糖、β(1-3)-葡聚糖间有β(1-4)共价键。
能够破坏酵母细胞壁的酶
立枯丝核菌(Rhizoctonia solani )源裂解酶 (Kitalase)
货号L8757 (粉末)
- 主要酶促活性为β-1,3-葡聚糖酶,也有报道存在蛋白酶、果胶酶和淀粉酶活性。
藤黄节杆菌(Arthrobacter luteus
)源裂解酶货号L2524 (粉末,最低2,000 un/mg 蛋白质)
货号L4025 (粉末,最低200 un/mg 固体)
货号L5263 (Zymolyase® 100T粉末,最低3,000 un/mg 蛋白质)
- 具有 β-1,3-葡聚糖昆布五糖水解酶和额外的 β-1,3-葡聚糖酶、蛋白酶和甘露聚糖酶活性。痕量的木聚糖酶、淀粉酶和磷酸酶活性。
- 有报道称可裂解核黄菌(Ashbya),假丝酵母(Candida),德巴利酵母(Debaryomyces),假囊酵母(Eremothecium),内孢霉(Endomyces),汉森酵母(Hansenula), 孢汉逊酵母(Hanseniaspora), 克勒克酵母(Kloeckera), 克鲁维酵母菌(Kluyveromyces),油脂酵母(Lipomyces),Metschikowia,毕赤酵母( Pichia),芽霉菌(Pullularia),球拟酵母(Torulopsis),酵母(Saccharomyces),覆膜孢酵母( Saccharomycopsis),类酵母(Saccharomycodes)和许旺酵母(Schwanniomyces)。
真核细胞毒素
毒素是活细胞内产生的有毒小分子、多肽和蛋白质。有些毒素作用于细胞表面分子,使它们能更容易进入细胞内部。这些毒素是研究者破坏细胞的重要工具。
用毒素改变细胞通透性
金黄色葡萄球菌(Staphylococcus aureus)源α-溶血素
货号H9395(冻干粉,≥10,000 units/mg 蛋白质)
- α-溶血素是33kD的胞外蛋白,大多数致病金黄色葡萄球菌都可分泌。
- 它有选择性溶血性,偏好兔红细胞。
- 它会引起皮肤坏死、肌肉瘫痪,对实验动物具有致死性。
- 毒素必须处于单体状态才能结合到膜上,不需要有特异性的受体。结合到生物膜或者人工合成膜上后,发生自低聚,产生正确环状结构(六聚体)的穿膜孔,实现离子和小代谢物透性。
- 业内认为α-溶血素会激活细胞磷脂酶,导致Ca2+流入,导致膜破坏、胞质组分流出、细胞膜不对称通透、细胞的渗透性溶解。
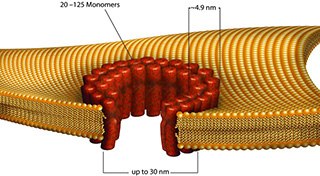
图 5.酿脓链球菌
破伤风杆菌(Clostridium tetani)源破伤风菌溶血素
货号T5319 (冻干粉)
- 胆固醇结合毒素能透化细胞膜,使大分子能进入细胞内部。产生的孔洞大小在20-50 nm之间。
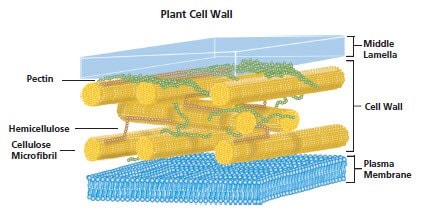
图 6.植物细胞壁
植物细胞由坚固的半透过细胞壁包裹。细胞壁主要由多糖和一些蛋白质和脂类组成。细胞壁三个主要多糖组分是纤维素、不带支链的β-(1-4)-D-链脲霉素聚合物形成的微纤维束。微纤维束由半纤维素(带支链的 β-(1-4)-D-木吡喃糖基多聚物)连接。交联结构镶嵌在胶质基质中(主要包含α-(1-4) 聚半乳糖醛酸骨架,该骨架可随机乙酰化和甲基化。)
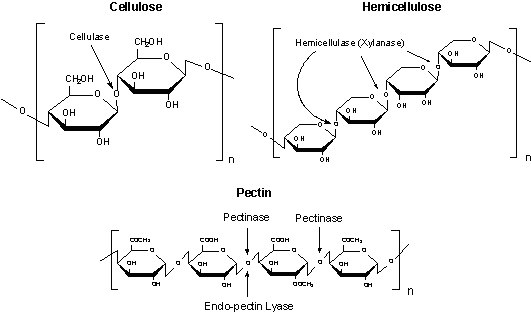
图 7.纤维素、半纤维素和果胶结构
纤维素酶
纤维素酶制剂是典型的多酶混合物,具有很高的纤维素酶和一些半纤维素酶活性。这些酶混合物能够降解纤维素,甘露聚糖,木聚糖,半乳甘露聚糖,胶质和其他多糖。
曲霉属(Aspergillus species)来源
货号C2605 (Novozymes Carezyme 1000 L)
货号V2010 (Novozymes Viscozyme L)
黑曲霉(Aspergillus niger)来源
货号C1184 (粉末,最低0.3 un/mg)
担子菌(Basidiomycetes)来源
货号D9515 (崩溃酶,粉末)
里氏木霉(Trichoderma reesei)来源
货号C8546 (粉末,最低1.0 un/mg)
货号C2730 (Novozymes Celluclast 1.5 L)
绿色木霉(Trichoderma viride)来源
货号C0615 (Yakult Onozuka RS)
货号C1794 (经细胞培养验证,粉末, min. 3.0-10 un/mg)
货号C9422 (粉末,最低3.0-10 un/mg)
果胶酶
果胶酶催化胶质和其他糖醛酸聚糖中的 1-4-α-D-半乳糖醛键随机水解。果胶酶催化(1-4)-α-D-半乳醛聚糖甲酯水解分裂,在非还原性末端释放出带有 4-脱氧-6-O-甲基-α-D-乳-4-糖醛酸基团的寡多糖。
果胶酶
棘孢曲霉(Aspergillus aculeatus) 来源
货号P2611 (Novozymes Pectinex Ultra SPL)
黑曲霉(Aspergillus niger)来源
货号P2736 (Novozymes Pectinex 3XL)
货号P4716 (甘油水溶液,最低5 un/mg 蛋白质)
货号P0690 (经植物细胞培养验证)
根霉属(Rhizopus species)来源
货号P2401 (Macerozyme R10粗粉400-800 un/g)
货号P4300 (经植物细胞培养测试)
果胶酶
日本曲霉(Aspergillus japonicus)来源
货号P3026 (冻干粉, 最低0.3 un/mg)
货号P5431 (冻干粉,最低2 un/mg)
货号 P5936 (经植物细胞培养验证)
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?